题目内容
5.下列说法正确的是( )| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1知,浓硫酸与氢氧化钠反应生成l mol H2O放出57.3KJ的热量 | |
| B. | 氯气和氨气的水溶液都能导电,所以它们是电解质 | |
| C. | 将纯水的温度由25℃升高至100℃,水的离子积将变大,pH也升高,此时呈现中性 | |
| D. | 除去MgCl2溶液中少量的FeCl3,可以加入MgO,然后过滤 |
分析 A、浓硫酸和碱反应之前先是稀释,稀释过程放出大量的热,据此回答;
B、氯气属于单质,不属于电解质的范畴,氨气的水溶液导电不是氨气本身导电;
C、水的电离是吸热的过程,水的离子积受温度的影响,据此回答;
D、根据影响铁离子水解的因素结合除杂的原则来回答.
解答 解:A、浓硫酸和碱反应之前先是稀释,稀释过程放出大量的热,浓硫酸与氢氧化钠反应生成l mol H2O放出大于57.3KJ 的热量,故A错误;
B、氯气属于单质,不属于电解质的范畴,氨气的水溶液导电不是氨气本身导电,氨气属于非电解质,故B错误;
C、水的电离是吸热的过程,纯水的温度由25℃升高至100℃,水的离子积将变大,氢离子浓度增大,pH降低,此时呈现中性,故C错误;
D、铁离子水解生成氢氧化铁和盐酸,除去MgCl2溶液中少量的FeCl3,可以加入MgO,促使氯化铁的水解平衡正向移动,铁离子形成氢氧化铁沉淀而除去,故D正确.
故选D.
点评 本题涉及中和反应的热效应、电解质的概念、水的电离平衡移动以及盐的水解原理的应用等知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
16.某校研究性学习小组采集学校附近河中水样,通过以下实验测定其pH
①用滴管吸取水样,然后用精密pH试纸测其pH
②将水样分成3份
③用同样的方法测定另2份水样
④用滴管吸取水样,然后用广泛pH试纸测其pH
正确的实验顺序为( )
①用滴管吸取水样,然后用精密pH试纸测其pH
②将水样分成3份
③用同样的方法测定另2份水样
④用滴管吸取水样,然后用广泛pH试纸测其pH
正确的实验顺序为( )
| A. | ②④③① | B. | ②④①③ | C. | ②①④③ | D. | ④②①③ |
13.根据表中信息,判断一下叙述正确的是( )
部分短周期元素的原子半径及主要化合价列表
部分短周期元素的原子半径及主要化合价列表
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的速率为L<Q | ||
| C. | M与T、Q与 T形成的化合物性质相似 | D. | L2+与R2-的核外电子数相等 |
20.某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置.请回答下列问题:
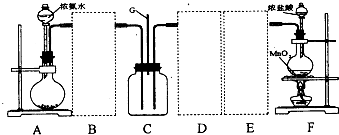
(1)装置A中烧瓶内的固体可选用ab.
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.

| I | Ii | Iii | |
| 备选装置 | 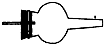 | 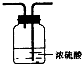 |  |
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.
10.下列食品添加剂与类别对应正确的一组是( )
| A. | 着色剂-亚硝酸盐 | B. | 疏松剂-碳酸氢铵 | C. | 调味剂-苯甲酸钠 | D. | 防腐剂-醋酸 |
17.已知胆矾溶于水时溶液温度降低,现测定室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为:CuSO4•5H2O(s)═CuSO4(s)+5H2O(l);△H=+Q2kJ•mol-1,则Q1、Q2关系为( )
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
14.某化学反应aA(g)═bB(g)+cC(g)在两种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化如表所示.回答下列问题.
(1)实验2中,反应进行10分钟时,该反应的速率v(A)=0.04mol/L.
(2)若实验1中进行到40分钟时,B、C的浓度分别为0.25mol/L、0.75mol/L,则该反应的化学方程式为2A?B+3C.
(3)若实验1、2在相同温度和压强下进行,但其中一个实验使用了催化剂.
①哪个实验使用了催化剂?答:实验2(填“实验1”或“实验2”).作出这种判断的依据是达到平衡的时间短.
②你认为催化剂是否会影响化学反应的限度?答:不会(填“会”或“不会”).作出这种判断的依据是催化剂只改变反应速率,不改变平衡移动.
| 实验 | 反应时间(min)及体系中A的浓度(mol/L) | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | |
| 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
(2)若实验1中进行到40分钟时,B、C的浓度分别为0.25mol/L、0.75mol/L,则该反应的化学方程式为2A?B+3C.
(3)若实验1、2在相同温度和压强下进行,但其中一个实验使用了催化剂.
①哪个实验使用了催化剂?答:实验2(填“实验1”或“实验2”).作出这种判断的依据是达到平衡的时间短.
②你认为催化剂是否会影响化学反应的限度?答:不会(填“会”或“不会”).作出这种判断的依据是催化剂只改变反应速率,不改变平衡移动.
15.下列各物质中的少量杂质,可用括号内的试剂和方法除去的是( )
| A. | 乙酸乙酯中溶有乙酸(浓硫酸,分液) | B. | 甲烷中含有乙烯(溴水,洗气) | ||
| C. | 汽油与水的混合物(苯,过滤) | D. | 乙醇中含有水(金属钠,蒸馏) |
