题目内容
14.某化学反应aA(g)═bB(g)+cC(g)在两种不同条件下进行,B、C的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化如表所示.回答下列问题.| 实验 | 反应时间(min)及体系中A的浓度(mol/L) | ||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | |
| 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
(2)若实验1中进行到40分钟时,B、C的浓度分别为0.25mol/L、0.75mol/L,则该反应的化学方程式为2A?B+3C.
(3)若实验1、2在相同温度和压强下进行,但其中一个实验使用了催化剂.
①哪个实验使用了催化剂?答:实验2(填“实验1”或“实验2”).作出这种判断的依据是达到平衡的时间短.
②你认为催化剂是否会影响化学反应的限度?答:不会(填“会”或“不会”).作出这种判断的依据是催化剂只改变反应速率,不改变平衡移动.
分析 (1)根据v(A)=$\frac{△c}{△t}$进行计算;
(2)根据反应改变的浓度之比等于系数之比判断反应物的系数来书写化学方程式;
(3)①根据反应速率快的实验使用了催化剂判断;
②催化剂只改变反应速率,不改变平衡移动,据此分析.
解答 解:(1)实验2中,根据图表数据反应进行10分钟时,该反应的速率v(A)=$\frac{△c}{△t}$=$\frac{1.0-0.6}{10}$=0.04mol/L,故答案为:0.04mol/L;
(2)根据图表数据,A、B、C改变的浓度之比等于(1-0.5):0.25:0.75=2:1:3,因为反应改变的浓度之比等于系数之比判断反应物的系数,所以反应的方程式为:2A?B+3C,故答案为:2A?B+3C;
(3)①因为催化剂加快反应速率,所以反应速率快的实验使用了催化剂,根据图表数据实验2先达到平衡反应速率快,则使用了催化剂,故答案为:实验2;达到平衡的时间短;
②因为催化剂只改变反应速率,不改变平衡移动,所以不会影响化学反应的限度,故答案为:不会;催化剂只改变反应速率,不改变平衡移动.
点评 本题考查反应速率的表示方法,化学平衡移动的判断,掌握反应速率的计算方法以及判断平衡移动原理是解题的关键,题目难度中等.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
4.标准状况下,10mL某气态烃,在足量的氧气中完全燃烧,得到40mLCO2,则该烃可能是( )
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
5.下列说法正确的是( )
| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1知,浓硫酸与氢氧化钠反应生成l mol H2O放出57.3KJ的热量 | |
| B. | 氯气和氨气的水溶液都能导电,所以它们是电解质 | |
| C. | 将纯水的温度由25℃升高至100℃,水的离子积将变大,pH也升高,此时呈现中性 | |
| D. | 除去MgCl2溶液中少量的FeCl3,可以加入MgO,然后过滤 |
2.锂不仅在军事工业中占有举足轻重的地位,而且在民用工业也是一种重要的材料.已知,锂的核电荷数为3.下列说法错误的是( )
| A. | 锂的原子半径比钠小 | B. | 锂原子核外有3个电子 | ||
| C. | 锂是第二周期IA族元素 | D. | LiOH的碱性比NaOH强 |
9.把一套以液化石油气(主要成分为C3H8和C4H10)为燃料的炉灶,现改用天然气(主要成分为CH4)为燃料,需要调整进入炉灶的燃料和空气的量.正确方法为( )
| A. | 只需调大燃料气的进气量 | B. | 只需调大空气的进气量 | ||
| C. | 同时调大燃料气和空气的量 | D. | 同时调小燃料气和空气的量 |
19.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | |
| B. | 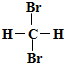 和 和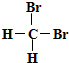 互为同分异构体 互为同分异构体 | |
| C. | CH3CH2CH2CH3与(CH3)2CHCH3互为同系物 | |
| D. | 金刚石、石墨、C60互为同素异形体 |
3.已知:锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
| A. | 1:4 | B. | 1:9 | C. | 1:8 | D. | 1:2 |
4.下列物质能使酸性高锰酸钾溶液褪色的是( )
| A. | 乙烷 | B. | 苯 | C. | 乙酸 | D. | 乙烯 |
 ;
;