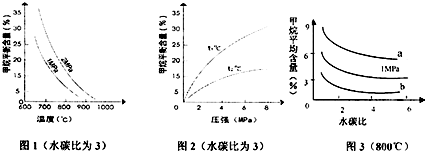
题目内容
20.某学习小组利用下列装置探究氯气和氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气和氨气的反应装置.请回答下列问题: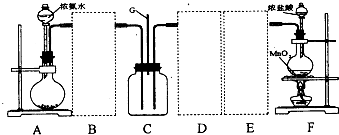
| I | Ii | Iii | |
| 备选装置 |  |  |  |
a.烧碱 b.生石灰. c.二氧化硅 d.五氧化二磷
(2)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择并将编号填入下列空格.BⅠ;DⅡ;EⅢ(填编号).装置I中需要的试剂是碱石灰.
(3)写出F中发生反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(4)装置C内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子的操作步骤:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子.
(5)该装置连接后尚存在的缺陷是:缺少尾气处理装置,污染环境.
分析 (1)A是氨气的制取装置,选取的固体能够吸收浓氨水中水分,放出氨气;
(2)根据杂质的性质选择除杂装置及除杂试剂;
(3)二氧化锰与浓盐酸在加热条件下发生反应生成氯化锰、氯气和水;
(4)氨气与氯气反应生成氮气和氯化氢,过量的氨气又能够与氨气发生反应生成氯化铵固体,所以其阳离子可能为氨根离子,检验氨根离子的存在通常可以加碱生成氨气,借助氨气能够使湿润的红色石蕊试纸变蓝检验;
(5)氨气、氯气、氯化氢都能够污染空气,需要进行尾气处理.
解答 解:(1)浓氨水易挥发,氢氧化钠固体、生石灰溶于水放出大量的热,能够促进氨气的挥发,可以用来制备氨气;二氧化硅不溶于水,五氧化二磷与氨水反应,不能用来制备氨气,
故答案为:ab;
(2)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ;
碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:Ⅰ;Ⅱ;Ⅲ;碱石灰;
(3)二氧化锰与浓盐酸在加热条件下发生反应生成氯化锰、氯气和水,反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)氨气与氯气反应生成氮气和氯化氢,过量的氨气又能够与氨气发生反应生成氯化铵固体,所以其阳离子可能为氨根离子,氨根离子的检验方法为:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子;
故答案为:取固体适量,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝色的气体,可证明阳离子为氨根离子;
(5)氨气、氯气、氯化氢都能够污染空气,需要进行尾气处理,故答案为:缺少尾气处理装置,污染环境.
点评 本提考查了氨气、氯气的制备和二者性质的检验,熟悉制备原理、各仪器的作用是解题关键,注意氨根离子检验方法,为高频考点,题目难度不大.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案| 物质 | 物理性质 | 化学性质 |
| 草酸(H2C2O4) | ①易溶于水 ②熔点189.5℃、100℃开始升华 ③草酸钙和草酸氢钙均是白色不溶物 | ①二元弱酸、酸性比碳酸强 ②有毒、具有腐蚀性 ③157℃左右分解、与浓硫酸混合会产生H2O、CO和CO2 |
| 草酸亚铁晶体(FeC2O4•2H2O) | ①浅黄色粉末状晶体 ②微溶于水,难溶于丙酮 | 受热易分解为氧化亚铁或铁单质 |
| 丙酮 | 与水互溶、易挥发 | ---- |
探究草酸的不稳定性.用下图中提供的仪器和试剂,验证草酸受热分解得到的混合气体中含有CO和CO2(加热装置和导管等在图中略去,部分装置可以重复使用).
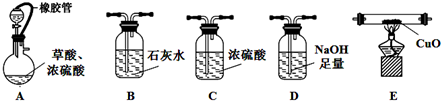
(1)仪器装置正确连接顺序为:ABDCEB.
(2)用上图入提供的装置和试剂实验时,在B中观察到有白色沉淀,也不能说明草酸分解有CO2,请提也改进意见在A与B之间添加一个盛水的洗气瓶,除去草酸蒸气(或在烧瓶上连接冷凝管).
【实验Ⅱ】
实验室用硝酸氧化淀粉水解液法制备草酸.装置如下图所示,反应原理为:
C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
实验步骤如下:
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55-60℃,边搅拌边缓慢滴加一定量的混合酸(65%的HNO3与98%的H2SO4的质量比2:1.25)
③反应3小时,蒸发浓缩、冷却结晶,抽滤后再重结晶得到草酸晶体
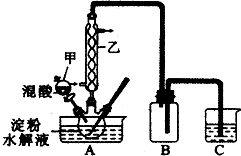
(3)上图实验装置中仪器乙的名称为:冷凝管、装置B的作用安全瓶,防止倒吸、C中试剂是NaOH溶液.
(4)检验淀粉是否水解完全的操作及现像是:取适量水解液于试管中,加入碘水,若溶液变蓝则淀粉水解完全,若溶液不变蓝则淀粉水解不完全.
【实验Ⅲ】
制备草酸亚铁晶体(FeC2O4•2H2O).反应原理为:
FeSO4•(NH4)2SO4•6H2O+H2C2O4=FeC2O4•2H2O+(NH4)2SO4+H2SO4+4H2O
实验步骤如下:
①称取13.7g FeSO4•(NH4)2SO4•6H2O放在200mL烧杯中,然后加30mL蒸馏水和2mL 2mol•L-1 H2SO4,加热溶解.
②再加入40mL 1mol•L-1草酸溶液,加热至沸,然后迅速搅拌(防止暴沸),待有黄色晶体析出后,停止加热,静置.
③弃去上层清液,用40mL蒸馏水充分洗涤晶体,过滤后,再用丙酮洗涤晶体并晾干得4.6g FeC2O4•2H2O
(5)生成的FeC2O4•2H2O需要充分洗涤,检验是否洗涤干净的操作及现像是用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净.
(6)用丙酮洗涤晶体的目的是减少草酸亚铁晶体的溶解,更快除去草酸亚铁晶体表面的水分.
(7)本实验FeC2O4•2H2O的产率为73.1%.
| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1知,浓硫酸与氢氧化钠反应生成l mol H2O放出57.3KJ的热量 | |
| B. | 氯气和氨气的水溶液都能导电,所以它们是电解质 | |
| C. | 将纯水的温度由25℃升高至100℃,水的离子积将变大,pH也升高,此时呈现中性 | |
| D. | 除去MgCl2溶液中少量的FeCl3,可以加入MgO,然后过滤 |
| A. | 物质的性质与用途: 磺胺类药物能抑制细菌合成核酸--治疗肺炎、脑膜炎、尿路感染、呼吸道感染 酸能与碱中和-----胃酸过多的病人服用含氢氧化镁的药物 | |
| B. | 保护环境: 控制“白色污染”--禁止使用所有塑料制品 防止水的污染--提倡使用无磷洗衣粉 | |
| C. | 基本安全常识: 饮用假酒中毒--由甲醇引起 食用假盐中毒--由亚硝酸钠引起 | |
| D. | 生活中的一些做法: 除去衣服上的油污--可用汽油洗涤 使煤燃烧更旺--可增大煤与空气接触面积 |
| A. | 只需调大燃料气的进气量 | B. | 只需调大空气的进气量 | ||
| C. | 同时调大燃料气和空气的量 | D. | 同时调小燃料气和空气的量 |
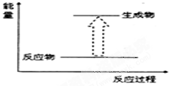
| A. | 乙醇与水反应 | |
| B. | 氧化钙与水反应 | |
| C. | 甲烷在氧气中燃烧 | |
| D. | 氢氧化钡晶体[Ba(OH)2•8H2O]与氯化铵晶体混合反应 |