题目内容
10.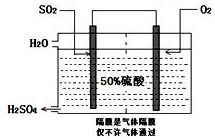 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.
分析 (1)工业制硫酸是在沸腾炉中燃烧黄铁矿;
(2)接触法制硫酸的过程中,接触室内为提高SO2的转化率通常会增加氧气的量,吸收塔内是用98.3%的浓硫酸吸收SO3得到发烟硫酸,结合原子利用率可知黄铁矿的损失与S的损失率等同,SO2的催化氧化是放热反应,升高温度可以提高反应速率,但平衡左移,反应物的转化率降低;
(3)利用原电池原理制硫酸溶液,通O2的极为正极,电极反应为O2+4e-+4H+=2H2O,通SO2的极为了负极,电极反应为2SO2-4e-+4H2O=2SO42-+8H+,结合正负极得失电子是相等的,即得原电池反应2SO2+O2+2H2O=2H2SO4,根据稀硫酸溶液的质量分数是50%,假设溶液里硫酸的质量为98g,据此可计算出通入SO2的质量和水的质量比;
(4)接触室发生的反应为2SO2(g)+O2(g)$\stackrel{△}{?}$2SO3(g)△H<0,升高温度平衡逆向移动,反应物的转化率降低,从图表中可以看出,恒温时增大压强平衡正向移动,但反应物的转化率变化幅度不大,但压强的增大消耗能源及对设备的要求也高,故不易高压,综合考虑可选择适宜温度和压强;
(5)①尾气中的二氧化硫是酸雨的主要来源和重要的化工原料,随意排放既污染大气,也是一种资源浪费,故对尾气要净化回收,选择处理方法时可以从原料的成本和资源等方面考虑;
②知道尾气的总量及SO2的含量可计算出尾气中SO2的总量,根据消耗的生石灰的质量可计算出吸收SO2的量,然后可求算出SO2的吸收率.
解答 (1)工业制硫酸是利用黄铁矿在沸腾炉中燃烧生成二氧化硫,然后在接触室催化氧化二氧化硫得三氧化硫,最后吸收塔用98%的浓硫酸吸收SO3,其中黄铁矿燃烧反应方程式为4FeS2 +11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,故答案为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2;沸腾炉;
(2)A、工业上SO2的催化氧化中通过增加O2也就是空气的体积来提高SO2的转化率;故A错误;
B、吸收塔是利用98.3%的浓硫酸吸收SO3得到的是发烟硫酸;故B错误;
C、煅烧黄铁矿的过程是化学变化,遵守原子守恒,黄铁矿和S的利用率相等,若黄铁矿损失了2%,则S
损失2%;故C正确;
D、接触室中采取高温是为了提高催化剂的活性,没有提高SO2的转化率,原因此反应是放热反应,升高
温度平衡逆向移动,SO2的转化率反而会降低;故D错误;
故答案为:C;
(3)利用原电池氧化SO2制硫酸的总反应式2SO2+O2+2H2O=2H2SO4,根据稀硫酸溶液的质量分数是50%,假设溶液里硫酸的质量为98g,溶液里水的质量也为98g,生成的硫酸的物质的量为$\frac{98g}{98g/mol}$=1mol,结合原电池反应式可知参加反应的SO2和H2O的物质的量也为1mol,则SO2的质量为1mol×64g/mol=64g,水的质量为1mol×18g/mol=18g,通入通入SO2的质量和水的质量比为$\frac{98g}{18g+98g}$=16﹕29,故答案为:16﹕29;
(4)从图中可看出恒压条件下升高温度,SO2的转化率降低,因此选择低温400℃,在恒温条件下增大压强,SO2的转化率增大幅度较小,考虑到产生高压会消耗能源及对设备的要求较高,因此选择较低压强为宜,故答案为:1个大气压、400℃;
(5)①通常用足量石灰水吸收尾气中的SO2生成CaSO3,然后再用稀硫酸处理CaSO3得到纯净的SO2和CaSO4,SO2可重新用来制硫酸,CaSO4制石膏,达到变废为宝的目的,另一方面制石灰水的生石灰成本也低,资源也丰富,故答案为:原料生石灰、硫酸价格便宜且容易获得;可得到石膏副产品;产生的SO2含量较高可再利用作为原料;
②排放的总尾气是1万立方米(标准状况)也就是107L,其中含0.2%(体积分数)SO2的体积为107L×0.2%=0.2×105L,35kg生石灰的物质的量为$\frac{35000g}{56g/mol}$=625mol,依据反应CaO+H2O=Ca(OH)2、Ca(OH)2+SO2=CaSO3+H2O可知吸收的SO2的物质的量也为625mol,吸收的SO2最多占SO2总物质的量的百分数(或体积分数)为$\frac{625mol×22.4L/mol}{20000L}×100%$=70%,故答案为:70%.
点评 考查硫酸的工业制法,涉及化学平衡的移动,原电池原理,原子守恒在化学计算中的应用,尾气的处理原则,反应条件的选择等,对学生基础要求较高,中等难度.

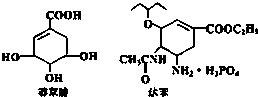 2005年禽流感在全球蔓延,百姓谈“禽”色变.目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物.下列有关描述正确的是( )
2005年禽流感在全球蔓延,百姓谈“禽”色变.目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物.下列有关描述正确的是( )| A. | 莽草酸、达菲都属于芳香族化合物 | |
| B. | 莽草酸既能发生加成反应,又能发生取代反应 | |
| C. | 莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色 | |
| D. | 1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为3mol |
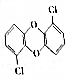 焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )
焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )| A. | 二噁英的摩尔质量是253 | |
| B. | 1 mol二噁英含有2mol氧原子 | |
| C. | 二噁英属于高分子化合物 | |
| D. | 1 mol二噁英在标准状况下的体积约为22.4L |
| 分子式 | 溶度积Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2•6H2O呈红色,常温下稳定.110~120℃时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.1×10-36 | 3.7 |
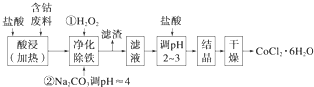
试回答:
(1)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.
(3)“滤液”中所含主要溶质的化学式是CoCl2、NaCl、HCl.
(4)为防止CoCl2•6H2O脱水,“干燥”时可采用的方法或操作是减压烘干晶体表面的水分,或常温下晾干,或常温下鼓风吹干,或低于100度小心烘干等.
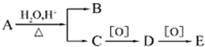 有机物A的分子式为C10H20O2,可发生如图的转化,其中B与E互为同分异构体且为同类物质,则A可能的结构有( )
有机物A的分子式为C10H20O2,可发生如图的转化,其中B与E互为同分异构体且为同类物质,则A可能的结构有( )| A. | 4种 | B. | 8种 | C. | 12种 | D. | 16种 |
| A. | 淀粉和纤维素 | B. | CH3CH2CH2CH3 与(CH3)2CHCH3 | ||
| C. | 1H 和2H | D. | O2与O3 |
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A. | 0.1mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 | |
| B. | NaHCO3溶液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(CO32-) | |
| C. | NaHSO3溶液中:c(Na+)>c(HSO${\;}_{3}^{-}$)>c(H2SO3)>c(SCO${\;}_{3}^{2-}$)+c(OH?) | |
| D. | 常温下,相同浓度的H2SO3、H2CO3、HClO三种溶液,pH最小的是H2SO3 |
 能源材料是当今科学研究的热点.氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料.继C60后,科学家又合成了Si60、N60,下列有关说法正确的是( )
能源材料是当今科学研究的热点.氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料.继C60后,科学家又合成了Si60、N60,下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60互为同分异构体 | |
| C. | 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石 |