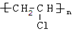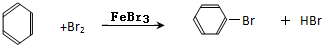题目内容
20.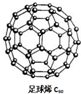 能源材料是当今科学研究的热点.氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料.继C60后,科学家又合成了Si60、N60,下列有关说法正确的是( )
能源材料是当今科学研究的热点.氢气作为一种清洁能源,必须解决它的储存问题,C60(结构见图)可用作储氢材料.继C60后,科学家又合成了Si60、N60,下列有关说法正确的是( )| A. | C60、Si60、N60都属于新型化合物 | |
| B. | C60、Si60、N60互为同分异构体 | |
| C. | 已知N60结构与C60相似,由于N-N键能小于N≡N,故N60的稳定性弱于N2 | |
| D. | 已知金刚石中C-C键长154pm,C60中C-C键长145~140pm,故C60熔点高于金刚石 |
分析 A.由一种元素组成的纯净物是单质,由两种或两种以上不同元素所组成的纯净物是化合物;
B.分子式相同结构不同的物质互称同分异构体;
C.键能越小,化学键越不稳定;
D.金刚石属于原子晶体,C60属于分子晶体,原子晶体的熔点更高.
解答 解:A.C60、Si60、N60都是只有一种元素组成的纯净物,属于单质,故A错误;
B.同分异构体研究对象为化合物,C60、Si60、N60都属于单质,且分子式不相同,不是同分异构体,故B错误;
C.N-N键能小于N≡N,键能越小,化学键越不稳定,故N60的稳定性弱于N2,故C正确;
D.金刚石属于原子晶体,C60属于分子晶体,故金刚石的熔点高于C60,故D错误;
故选:C.
点评 本题考查了物质的分类,晶体类型与熔点的关系,注意晶体类型的判断,题目难度不大.

练习册系列答案
相关题目
10.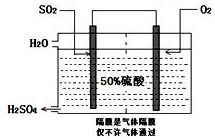 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
(5)硫酸工厂排放的尾气中,含少量二氧化硫.为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用.硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.
15.下列有关于焰色反应说法错误的是( )
| A. | 焰色反应是物理变化,利用的是元素的性质 | |
| B. | 焰色反应一般用铂丝,细铁丝蘸取药品做相关实验 | |
| C. | 更换样品时,需用盐酸洗涤铂丝,然后在酒精灯上灼烧至几乎无色才能蘸取新样品 | |
| D. | 某物质焰色反应是黄色,则一定含有钠元素,不可能含有钾元素 |
12.钢铁暴露在潮湿的空气中会发生析氢腐蚀或吸氧腐蚀,发生吸氧腐蚀时正极反应式为( )
| A. | 4H++4e-=2H2↑ | B. | 2H2O+O2+4e-=4OH- | ||
| C. | 2Fe-4e-=2Fe2+ | D. | 4OH--4e-=2H2O+O2↑ |
9.下列有关化学用语表示正确的是( )
| A. | 赤铁矿的主要成份的化学式:Fe3O4 | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | 氯离子的结构示意图: | |
| D. | 中子数为14的铝原子:${\;}_{13}^{14}$Al |
10.将金属钠分别投入下列物质的稀溶液中,有气体生成,且溶液质量减轻的是( )
| A. | 氢氧化钠 | B. | 硫酸 | C. | 氯化铜 | D. | 硫酸钠 |
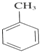 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$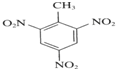 +3H2O
+3H2O