题目内容
20.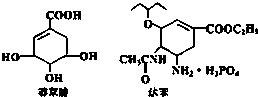 2005年禽流感在全球蔓延,百姓谈“禽”色变.目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物.下列有关描述正确的是( )
2005年禽流感在全球蔓延,百姓谈“禽”色变.目前通过从香料八角中提取的莽草酸制得的达菲是抗禽流感病毒特效药物.下列有关描述正确的是( )| A. | 莽草酸、达菲都属于芳香族化合物 | |
| B. | 莽草酸既能发生加成反应,又能发生取代反应 | |
| C. | 莽草酸、达菲都能使溴水或酸性KMnO4溶液褪色 | |
| D. | 1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为3mol |
分析 莽草酸中含碳碳双键、-COOH、-OH,具有烯烃、羧酸、醇的性质;达菲中含碳碳双键、-COOC-、羰基、醚键等,以此来解答.
解答 解:A.均不含苯环,均不属于芳香族化合物,故A错误;
B.莽草酸中含碳碳双键可发生加成反应,含-COOH、-OH可发生取代反应,故B正确;
C.均含碳碳双键,则都能使溴水或酸性KMnO4溶液褪色,故C正确;
D.达菲中-COOC-与H3PO4均与NaOH反应,1mol达菲与NaOH溶液反应,消耗NaOH的物质的量最多为4mol,故D错误;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇、酯的性质及分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.下列离子方程式的书写正确的是( )
| A. | 水玻璃中通人过量二氧化碳:Na2SiO3+CO2+H2═2Na++CO${\;}_{3}^{2-}$+H2SiO3 | |
| B. | Na202加入H2180中:2Na2O2+2H${\;}_{2}^{18}$O═4Na++4OH-+${\;}_{\;}^{18}$O2↑ | |
| C. | 硅与氢氟酸的反应:Si+4H++4F-═SiF4↑+2H2↑ | |
| D. | 过量C02通入氢氧化钙溶液中:CO2+OH-═HCO${\;}_{3}^{-}$ |
11.一定量某营养液中溶质的配方分别如下:
配方一:0.3mol KCl、0.2mol K2SO4、0.1molZnSO4
配方二:0.1mol KCl、a mol K2SO4、0.1molZnCl2
对于两种营养液的成分,下列说法中不正确的是( )
配方一:0.3mol KCl、0.2mol K2SO4、0.1molZnSO4
配方二:0.1mol KCl、a mol K2SO4、0.1molZnCl2
对于两种营养液的成分,下列说法中不正确的是( )
| A. | 两配方中n(Cl-)相同 | |
| B. | 两配方中n(Zn2+)和a的取值无关 | |
| C. | 当a=0.3时两配方中各种离子的物质的量分别相同 | |
| D. | 当a=0.2时两配方中n(Cl-)、n(Zn2+)和n(SO42-)分别相同 |
8.有关化学用语正确的是( )
| A. | 质子数27的钴-60原子:60 27Co | |
| B. | 氯化铵的电子式: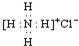 | |
| C. | S2-的结构示意图: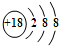 | |
| D. | Cl-的电子排布式:1s22s22p63s23p5 |
15.下列实验或生产操作:①蛋白质溶液中加入硫酸铵形成沉淀;②二氧化氮经加压凝成无色液体;③石蜡催化裂化;④碘受热变成碘蒸汽;⑤照相底片被感光;⑥煤的干馏.没有新的物质生成的是( )
| A. | ①④ | B. | ②③⑥ | C. | ①③⑤ | D. | ①②④ |
5.反应物和生成物均为气态的平衡体系,平衡常数表达式为:K=$\frac{c(x)•{c}^{2}(y)}{{c}^{3}(z)•{c}^{2}(w)}$,有关该平衡体系说法不正确的是( )
| A. | 升高温度,该反应平衡常数K的变化无法判断 | |
| B. | 增大压强,W的质量分数减小 | |
| C. | 该反应的化学方程式为:3z(g)+2w(g)?x(g)+2y(g) | |
| D. | 增大X气体浓度平衡向正反应方向移动 |
12.下列指定反应的离子方程式正确的是( )
| A. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 醋酸加入碳酸钙中:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
10.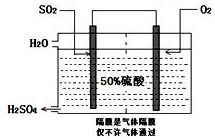 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
(5)硫酸工厂排放的尾气中,含少量二氧化硫.为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用.硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.

 .
.