题目内容
1.按要求填写下列空格.①0.5molH2O约含3.01×1024个质子;
②53gNa2CO3含6.02×1023个Na+;
③1.204×1024个水分子的质量为36 克;
④5mol的CO2与8mol的SO2原子数比是5:8;
⑤标准状况下,体积为11.2L 的CO2所含原子的总数是9.03×1023个.
分析 ①质子物质的量为水的10倍,根据N=nNA计算质子数目;
②根据n=$\frac{m}{M}$计算碳酸钠物质的量,钠离子物质的量为碳酸钠的2倍,再根据N=nNA计算钠离子数目;
③根据n=$\frac{N}{{N}_{A}}$计算水的物质的量,再根据m=nM计算水的质量;
④CO2、SO2分子均含有3个原子,含有的原子数目之比等于它们的物质的量之比;
⑤根据n=$\frac{V}{{V}_{m}}$计算二氧化碳物质的量,含有原子物质的量为碳酸钠的3倍,再根据m=nM计算原子数目.
解答 解:①每个水分子含有19个质子,则含有质子数目为0.5mol×10×6.02×1023mol-1=3.01×1024,故答案为:3.01×1024;
②53gNa2CO3的物质的量为$\frac{53g}{106g/mol}$=0.5mol,含有Na+离子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故答案为:6.02×1023;
③1.204×1024个水分子的物质的量为$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,其质量为2mol×18g/mol=36g,故答案为:36;
④CO2、SO2分子均含有3个原子,含有的原子数目之比等于它们的物质的量之比,即5mol的CO2与8mol的SO2原子数比是5:8,故答案为:5:8;
⑤标准状况下,11.2L 的CO2物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,含有原子的总数是0.5mol×3×6.02×1023mol-1=9.03×1023,故答案为:9.03×1023.
点评 本题考查物质的量的有关计算,比较基础,注意掌握以物质的量为中心的计算.

 阅读快车系列答案
阅读快车系列答案配方一:0.3mol KCl、0.2mol K2SO4、0.1molZnSO4
配方二:0.1mol KCl、a mol K2SO4、0.1molZnCl2
对于两种营养液的成分,下列说法中不正确的是( )
| A. | 两配方中n(Cl-)相同 | |
| B. | 两配方中n(Zn2+)和a的取值无关 | |
| C. | 当a=0.3时两配方中各种离子的物质的量分别相同 | |
| D. | 当a=0.2时两配方中n(Cl-)、n(Zn2+)和n(SO42-)分别相同 |
| A. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 醋酸加入碳酸钙中:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| D. | 硅酸钠溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32- |
| A. | 0.4 mol NH3 | B. | 4℃时5.4 mL水(水的密度为1g/cm3) | ||
| C. | 10 g氖气 | D. | 6.02×1023个硫酸分子 |
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 在一定的温度和压强下,各种气体的摩尔体积相等 | |
| C. | 阿伏加德罗常数的数值是0.012kg14C所含的原子个数 | |
| D. | 若气体摩尔体积为22.4L•mol-1,则所处条件为标准状况 |
| A. | 一个分子中含有几个氢原子就是几元酸 | |
| B. | 分子数为NA的CO、C2H4混合气体质量为28g,标准状况下的体积约为22.4 L | |
| C. | 所含原子数相等的CO与CO2的密度之比为7:11 | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
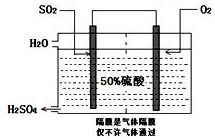 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.

 .
.