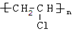题目内容
18.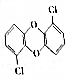 焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )
焚烧医药废品和生活垃圾会产生强致癌性的二噁英(结构简式如图),其沸点为302℃.下列有关判断正确的是( )| A. | 二噁英的摩尔质量是253 | |
| B. | 1 mol二噁英含有2mol氧原子 | |
| C. | 二噁英属于高分子化合物 | |
| D. | 1 mol二噁英在标准状况下的体积约为22.4L |
分析 有机物沸点为302℃,常温下为固体,含有Cl原子和醚基,结合结构简式可确定有机物分子式,进而确定摩尔质量,以此解答该题.
解答 解:A.有机物分子式为C12H6O2Cl2,摩尔质量是253g/mol,故A错误;
B.由分子式可知1 mol二噁英含有2mol氧原子,故B正确;
C.有机物相对分子质量远小于10000,不是高分子化合物,故C错误;
D.二噁英在标准状况下为固体,不适用气体摩尔体积,故D错误.
故选B.
点评 本题考查有机物的组成、结构,为高频考点,侧重于学生的分析能力的考查,难度不大.

练习册系列答案
相关题目
8.有关化学用语正确的是( )
| A. | 质子数27的钴-60原子:60 27Co | |
| B. | 氯化铵的电子式: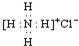 | |
| C. | S2-的结构示意图: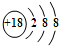 | |
| D. | Cl-的电子排布式:1s22s22p63s23p5 |
6.下列说法正确的是( )
| A. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| B. | 在一定的温度和压强下,各种气体的摩尔体积相等 | |
| C. | 阿伏加德罗常数的数值是0.012kg14C所含的原子个数 | |
| D. | 若气体摩尔体积为22.4L•mol-1,则所处条件为标准状况 |
13.下列叙述正确的是( )
| A. | 一个分子中含有几个氢原子就是几元酸 | |
| B. | 分子数为NA的CO、C2H4混合气体质量为28g,标准状况下的体积约为22.4 L | |
| C. | 所含原子数相等的CO与CO2的密度之比为7:11 | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
10. 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
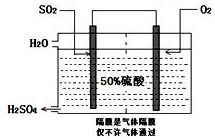
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
(5)硫酸工厂排放的尾气中,含少量二氧化硫.为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用.硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.
 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.

 .
.
 ;
; .
.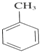 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$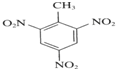 +3H2O
+3H2O