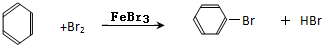题目内容
19.常温下,浓度均为0.1mol/L的4种溶液的pH如表:| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A. | 0.1mol/L Na2CO3溶液加水,稀释后溶液中所有离子的浓度均减少 | |
| B. | NaHCO3溶液中:c(Na+)+c(H+)=c(HSO3-)+c(OH-)+c(CO32-) | |
| C. | NaHSO3溶液中:c(Na+)>c(HSO${\;}_{3}^{-}$)>c(H2SO3)>c(SCO${\;}_{3}^{2-}$)+c(OH?) | |
| D. | 常温下,相同浓度的H2SO3、H2CO3、HClO三种溶液,pH最小的是H2SO3 |
分析 根据相同浓度的钠盐溶液pH大小知,酸根离子水解程度大小顺序是:CO32->ClO->HCO3->HSO3-,则酸的强弱顺序是H2SO3>H2CO3>HClO>HCO3-,
A.碳酸钠溶液中存在碳酸根离子的水解,加水稀释促进水解正向进行,平衡状态下的离子浓度减小,溶液中存在离子积常数,氢氧根离子浓度减小,氢离子浓度增大;
B.依据溶液中电荷守恒分析判断;
C.亚硫酸氢钠溶液呈酸性,说明HSO3-电离程度大于水解程度,无论电离还是水解其程度都较小;
D.酸根离子水解程度越大,则酸的酸性越弱.
解答 解:根据相同浓度的钠盐溶液pH大小知,酸根离子水解程度大小顺序是:CO32->ClO->HCO3->HSO3-,则酸的强弱顺序是H2SO3>H2CO3>HClO>HCO3-,
A.碳酸钠溶液中存在碳酸根离子的水解,加水稀释促进水解正向进行,平衡状态下的离子浓度减小,溶液中存在离子积常数,氢氧根离子浓度减小,氢离子浓度增大,故A错误;
B.碳酸氢钠溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3-)+c(OH-)+2c(CO32-),故B错误;
C.亚硫酸氢钠溶液呈酸性,说明HSO3-电离程度大于水解程度,无论电离还是水解其程度都较小,所以c(H2SO3)<c(SO32-),故C错误;
D.酸根离子水解程度越大,则酸的酸性越弱,酸根离子水解程度大小顺序是:CO32->ClO->HCO3->HSO3-,则酸的强弱顺序是H2SO3>H2CO3>HClO>HCO3-,所以常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是HClO溶液,PH最小的是H2SO3,故D正确;
故选D.
点评 本题考查了盐类水解,根据钠盐溶液pH大小确定相对应酸的强弱,再结合强酸制取弱酸、酸式酸根离子电离和水解程度相对大小等知识点来分析解答,题目难度中等.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案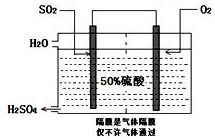 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸.(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:4FeS2 +11 O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,该反应在沸腾炉(填设备名称)中进行.
(2)有关接触法制硫酸的下列说法中,正确的是C.
A、工业上SO2的催化氧化中SO2和O2的体积比恰好为2:1
B、吸收塔得到的是98.3%的浓硫酸
C、煅烧含硫48%的黄铁矿时,若黄铁矿损失了2%,则S损失2%
D、接触室中采取高温是为了提高催化剂的活性和提高SO2的转化率
(3)科研工作者开发了制备SO2,再用电化学原理生产硫酸的方法,装置如图:为了稳定技术生产,硫酸的浓度应维持不变,则通入的SO2和水的质量比为16﹕29.
(4)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是4000C 1个大气压.
 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
①请写出这种尾气处理方法的优点(写出两点即可):原料生石灰、硫酸价格便宜且容易获得、可得到石膏副产品.
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上用生石灰35kg,吸收的SO2最多占SO2总物质的量的70%.
| A. | 同分异构体之间分子式相同,其式量也一定相等,式量相等的物质一定是同分异构体 | |
| B. | 同分异构体之间某种元素的质量分数均相同,化合物之间某种元素质量分数均相同的物质一定为同分异构体 | |
| C. | 两种物质如果互为同分异构体,则一定不可能为同系物 | |
| D. | 两种物质如果互为同分异构体,则它们的命名可能一样 |
| A. | 赤铁矿的主要成份的化学式:Fe3O4 | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | 氯离子的结构示意图: | |
| D. | 中子数为14的铝原子:${\;}_{13}^{14}$Al |

 .
. ;
;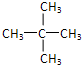 .
.
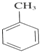 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$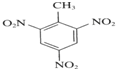 +3H2O
+3H2O