题目内容
5.向20mLAlCl3溶液中滴入2mol•L-1NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:(1)图中所示的AB段所发生的反应的离子方程式为:Al3++3OH-=Al(OH)3↓;
(2)假设溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为7.5mL、17.5mL.

分析 向20mLAlCl3溶液中滴入2mol•L-1NaOH溶液,由图可知,OA发生AlCl3+3NaOH=Al(OH)3↓+3NaCl,AB发生Al(OH)3+NaOH=NaAlO2+2H2O,最多生成沉淀质量为7.8g,溶液中有Al(OH)3沉淀0.39g,有两种可能,碱不足或碱过量,以此计算解答.
解答 解:(1)AB段所发生的反应的离子方程式为Al3++3OH-=Al(OH)3↓,故答案为:Al3++3OH-=Al(OH)3↓;
(2)由图象分析知,当沉淀的质量为最大值的一半时,对应的氢氧化钠的体积有两个,一个是氢氧化钠不足量生成0.39g沉淀所用的体积,一个是有部分沉淀溶解所需氢氧化钠的体积.
①碱不足时,设生成0.39g沉淀需氢氧化钠的体积为xL,
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3mol 78g
2mol/L×xL 0.39g
x=0.0075,
则氢氧化钠的体积为7.5mL;
②部分沉淀溶解时设生成0.39g沉淀所需氢氧化钠的体积为yL;
AlCl3+3NaOH=Al(OH)3↓+3NaCl
3mol 78g
2mol/L×yL 0.78g
y=0.015
即15mL;
设有0.39g溶解所需氢氧化钠的体积为zL,
Al(OH)3+NaOH=NaAlO2+2H2O
78g 1mol
0.39g 2mol/L×z L
z=0.0025
即2.5mL
所以当有0.39g沉淀生成时消耗氢氧化钠的体积为15mL+2.5mL=17.5 mL,
故答案为:7.5 mL;17.5 mL.
点评 本题考查化学反应的计算,为高频考点,把握反应与图象的对应关系为解答的关键,注意氢氧化铝的两性,侧重分析与计算能力的考查,题目难度不大.

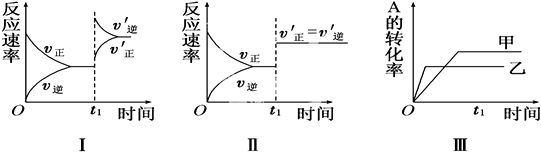
| A. | 图Ⅰ表示的是t1时刻升高温度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 | |
| D. | 图Ⅲ表示的是温度对平衡的影响,且乙的温度比甲高 |
| A. | C8H10 | B. | C10H16 | C. | C12H22 | D. | C14H22 |
 ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
| 化合物 | 甲烷 | 乙烷 | 丙烷 | 正丁烷 | 异丁烷 | 异戊烷 |
| 燃烧热 (kJ•mol-1) | 891.0 | 1560.8 | 2221.5 | 2878.0 | 2869.6 | 3531.3 |
| A. | 正丁烷?异丁烷△H<0 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═CO2(g)+6H2O(g)△H=-1560.8 kJ•mol-1 | |
| C. | 正戊烷的燃烧热数值小于3531.3 kJ•mol-1 | |
| D. | 相同质量的烷烃,随碳原子数增加,燃烧放出的热量增多 |
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 苯制溴苯、乙烯制乙醇 | |
| B. | 甲烷制一氯甲烷、苯制硝基苯 | |
| C. | 乙醇制乙醛、乙醇和乙酸制乙酸乙酯 | |
| D. | 苯制环己烷、乙酸乙酯水解 |
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
| A. | 氢硫酸 | B. | 二氧化碳 | C. | 氯化钾 | D. | 醋酸钠 |