题目内容
20.一些烷烃的燃烧热数值(kJ•mol-1)如表:下列推断正确的是( )| 化合物 | 甲烷 | 乙烷 | 丙烷 | 正丁烷 | 异丁烷 | 异戊烷 |
| 燃烧热 (kJ•mol-1) | 891.0 | 1560.8 | 2221.5 | 2878.0 | 2869.6 | 3531.3 |
| A. | 正丁烷?异丁烷△H<0 | |
| B. | 乙烷燃烧的热化学方程式为:2C2H6(g)+7O2(g)═CO2(g)+6H2O(g)△H=-1560.8 kJ•mol-1 | |
| C. | 正戊烷的燃烧热数值小于3531.3 kJ•mol-1 | |
| D. | 相同质量的烷烃,随碳原子数增加,燃烧放出的热量增多 |
分析 A、根据正丁烷和异丁烷的燃烧热判断能量高低;
B、乙烷的燃烧热为1560.8KJ/mol,说明完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量;
C、正丁烷的燃烧热和其同分异构体的燃烧热相近,比含有支链的同分异构体高点,以此来分析正戊烷的燃烧热;
D、相同质量的烷烃,燃烧放热多少和碳的质量分数有关.
解答 解:A、因为正丁烷的燃烧热比异丁烷大,所以等量的正丁烷能量比异丁烷大,则正丁烷?异丁烷放热即△H<0,故A正确;
B、根据乙烷燃烧热的含义:完全燃烧1mol乙烷生成二氧化碳和液态水时会放出1560.8KJ的热量,所以热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l);△H=-3121.6kJ/mol,故B错误;
C、正戊烷和2-甲基丁烷互为同分异构体,由表格中正丁烷、异丁烷的燃烧热比较可知,则互为同分异构体的化合物,支链多的燃烧热小,则正丁烷的燃烧热大于2-甲基丁烷,即正戊烷的燃烧热大约在3540KJ/mol左右,且大于3531.3KJ/mol,故C错误;
D、相同质量的烷烃,碳的质量分数越小,燃烧放热越多,故D错误.
故选A.
点评 本题是一道关于化学反应中的能量变化以及燃烧热概念的题目,可以根据所学知识进行回答,难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案
相关题目
10.下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A. | NaCl溶液中有杂质Na2SO4(适量的BaCl2溶液) | |
| B. | FeSO4溶液中有杂质CuSO4 (Fe粉) | |
| C. | CO2气体中有少量CO(灼热的氧化铜) | |
| D. | SO2气体中有少量HCl气体(NaOH溶液) |
8.下表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为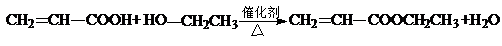 .
.
| A | 1使溴的四氯化碳溶液褪色;②比例模型为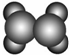 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为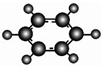 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为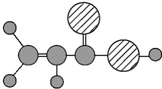 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为
15.在化工生产和科学研究中各种酸具有重要的用途.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
则在相同条件下0.1mol/L HClO4的乙酸溶液与0.1 mol/L HAc水溶液导电能力最接近.
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.
(1)磷酸是一种三元中强酸,在溶液中各种含P粒子的百分数(δ)与溶液的pH关系如图:则磷酸的第二级电离平衡常数约为10-7;Na2HPO4溶液的pH约为10,说明HPO4-水解程度大于电离程度(用其电离与水解程度来解释),Na2HPO4溶液的物料守恒式为c(Na+)=2[c(H3PO4)+c(H2PO4-)+c(HPO42-)+c(PO43-)].
(2)乙酸(用HAC来表示)是一种重要的化工原料也可作溶剂.HClO4、HCl、HNO3、H2SO4在无水乙酸中都是弱酸,存在如下电离平衡(电离常数均为常温下的数值):
HClO4+HAC═H2AC++ClO4-K═1.6×10-5
HCl+HAC═H2AC++Cl-K═1.6×10-9
HNO3+HAC═H2AC++NO3-K═4.2×10-10
H2SO4+HAC═H2AC++HSO4-K═6.3×10-9
①H2AC+的名称为乙酸合氢离子;用乙酸作溶剂时,HClO4、HCl、HNO3、H2SO4的酸性由强到弱的排序为HClO4、H2SO4、HCl、HNO3;在0.01mol/L HNO3的乙酸溶液中,c(NO3-)=2×10-6(计算结果保留一位有效数字).
②已知如表酸在水中的电离常数(25℃)
| 酸 | HCN | HAc | HF | H2SO3 |
| Ka | 4.9×10-10 | 1.75×10-5 | 3.5×10-4 | K1=1.5×10-2 |
(3)混酸(浓硫酸和浓硝酸的混合物)是常用的硝化试剂,其中含有硝化反应的中间体NO2+,其反应是:2H2SO4+HNO3═[NO2]+[HSO4]-+[H3O+][HSO4]-.根据中和反应的原理判断此反应中HNO3作为碱;NO2+与CO2或N2O或N3-或-OCN(填化学式)的原子数和电子数相同、结构相似;H3O+的空间构型为三角锥形.

10.下列有关溶液的说法不正确的是( )
| A. | 溶液由溶质和溶剂组成,所以每种溶液里只有两种物质 | |
| B. | 硫酸钠溶液能导电是因为溶液中含有较多自由移动的离子 | |
| C. | 配置0.09%的生理盐水的一般步骤是计算、称量和溶解 | |
| D. | 在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中 |
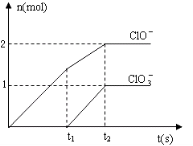 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
