题目内容
13.已知:2Cu(IO3)2+24KI+□ ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )
,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则参加反应的Cu(IO3)2物质的量为( )| A. | $\frac{n}{10}$ mol | B. | $\frac{n}{11}$ mol | C. | $\frac{n}{12}$ mol | D. | $\frac{n}{13}$ mol |
分析 根据生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-)结合得失电子守恒计算生成的碘,再代入方程式计算参加反应的Cu(IO3)2物质的量.
解答 解:根据得失电子守恒,生成的I2刚好消耗n mol S2O32-(S2O32-被氧化为S4O62-),则生成的I2的物质的量为:$\frac{n×(2.5-2)×2}{2}$=0.5n,再由2Cu(IO3)2+24KI+□ ═2CuI↓+13I2+□K2SO4+□
═2CuI↓+13I2+□K2SO4+□ ,则参加反应的Cu(IO3)2物质的量为0.5n×$\frac{2}{13}$=$\frac{n}{13}$,故选:D.
,则参加反应的Cu(IO3)2物质的量为0.5n×$\frac{2}{13}$=$\frac{n}{13}$,故选:D.
点评 本题考查氧化还原反应中的计算,明确反应中得失电子守恒是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
3.阅读下表中短周期主族元素的相关信息.
请回答:
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式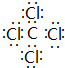 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是常用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)写出E在元素周期表中的位置:第二周期第ⅣA族;C与D形成的化合物类型是共价化合物(离子化合物、共价化合物)
(2)写出A2B2晶体中存在的化学键:离子键、共价键.
(3)A在真空、高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称.写出Y的电子式
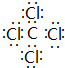 ,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
,并写出该反应的化学方程式4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.(4)常温下,0.1mol•L-1 X溶液的pH>7(填“>”“=”或“<”).简述X可以做家用消毒剂的理由:ClO-+H2O?HClO+OH-.(用化学方程式表示)
(5)写出A2B2和EB2反应的化学方程式:2Na2O2+2CO2═2Na2CO3+O2. 指出氧化剂是Na2O2、还原剂是Na2O2.
8.下表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为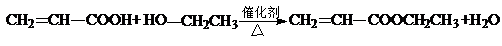 .
.
| A | 1使溴的四氯化碳溶液褪色;②比例模型为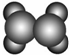 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为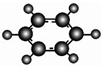 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为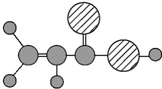 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为
2.下列实验能达到预期目的是( )
| A. | 向煮沸的1mol/L NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 用氢氧化铜粉末检验尿糖 | |
| C. | 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 | |
| D. | 用醋和澄清石灰水验证蛋壳中含有碳酸盐 |
3.现有部分短周期元素的性质或原子结构如下表:
(1)用化学用语回答下列问题:
①A元素在周期表中的位置第三周期第ⅥA族;
②用电子式表示A和B元素组成的化合物的形成过程 .
.
(2)元素D与元素A相比,D非金属性较强,下列表述中能证明这一事实的是bde.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
①A元素在周期表中的位置第三周期第ⅥA族;
②用电子式表示A和B元素组成的化合物的形成过程
 .
.(2)元素D与元素A相比,D非金属性较强,下列表述中能证明这一事实的是bde.
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
d.A的最高价含氧酸酸性弱于D的最高价含氧酸
e.D单质能与A的氢化物反应生成A单质
(3)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是NaOH(写化学式).
(4)X是由A、B、C、D四种元素中的某种元素组成的单质,能经下图所示的过程转化为W(其他条件略去).
X$\stackrel{O_{2}}{→}$Y$\stackrel{O_{2}}{→}$Z$\stackrel{H_{2}O}{→}$W
①若Y是有刺激性气味的无色气体,把Y通入BaCl2溶液中,然后滴加适量H2O2溶液,有白色沉淀生成,此白色沉淀的化学式为:BaSO4;生成该白色沉淀的化学方程式为BaCl2+SO2+H2O2=BaSO4↓+2HCl.
②若Z是红棕色气体,则Z→W的反应中氧化剂与还原剂物质的量之比为1:2.
 天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去.
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去. ;羰基硫分子的电子式为
;羰基硫分子的电子式为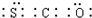 .
.