题目内容
下列说法正确的是
| A.熔化干冰和熔化NaCl晶体所克服的作用力相同 |
| B.氢键比分子间作用力强,所以它属于化学键 |
| C.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D.冰的密度比水小,这是由于冰中存在氢键所致 |
D
解析试题分析:A.熔化干冰所克服的作用力是范德华力,熔化NaCl晶体所克服的作用力离子键。二者不相同;B.氢键比范德华力强,但它们都属于分子间作用力,B错;C.H2O是一种非常稳定的化合物,这是由于H—O键能大所致,是化学性质,与物理性质分子间氢键无关;D.冰的密度比水小,这是由于冰中存在氢键所致,氢键有方向性和饱和性,不能密堆积有关,正确。
考点:微粒间作用力类型和形成特征。

练习册系列答案
相关题目
下列各组物质熔化或气化时,所克服的微粒间的作用力属同种类型的是
| A.SiO2和干冰的熔化 | B.氧化钠和钠的熔化 |
| C.晶体硅和晶体硫的熔化 | D.碘和干冰的气化 |
羰基硫(OCS)是一种有臭鸡蛋气味的无色气体,分子结构与CO2相似,高温下分解为CO和S。下列有关说法正确的是( )
| A.OCS、CO2、CO、S晶体类型相同 |
| B.OCS高温分解时,碳元素化合价升高 |
| C.OCS中含有1个σ键和1个π键 |
| D.22.4 L OCS中约含有3×6.02× 1023个原子 |
下列说法错误的是
| A.含有共价键的化合物一定是共价化合物 |
| B.在共价化合物中一定含有共价键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.双原子单质分子中的共价键一定是非极性键 |
正硼酸(H3BO3)是一种层状结构的白色晶体,层内的H3BO3分子通过氢键相连(如图)。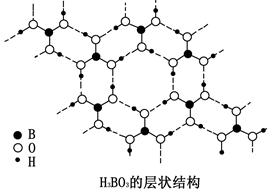
下列有关说法正确的是
| A.正硼酸晶体属于原子晶体 | B.H3BO3分子的稳定性与氢键有关 |
| C.分子中硼原子最外层为8电子稳定结构 | D.含1molH3BO3的晶体中有3mol氢键 |
中心原子采取sp2杂化的是 ( )
| A.NH3 | B.BCl3 | C.PCl3 | D.H2O |
下列有关化学键与晶体结构说法正确的是
| A.两种元素组成的分子中一定只有极性键 |
| B.离子化合物的熔点一定比共价化合物的高 |
| C.非金属元素组成的化合物一定是共价化合物 |
| D.含有阴离子的化合物一定含有阳离子 |
下列物质中,既含离子键又含非极性共价键的是 ( )
| A.Na2O2 | B.H2O | C.HClO | D.NaOH |