题目内容
A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A________,E________。
(2)D在周期表中位于第_______周期第________族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示)_______________。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式____________________________________________________________。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是_____________。
(1)H,Na
(2)2,VI A
(3)E > B > C > D > A
(4)NH4HCO3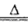 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
(5)乙二酸(草酸)
解析试题分析:(1)B是形成化合物种类最多的元素,B是C元素;D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物,猜测D是O元素,则A是H元素,C是N元素,H、C、N、O的原子序数和是E的原子序数的2倍,则E是Na元素。符合Na的阳离子与O的阴离子都比H阳离子多2个电子层,说明推断正确。
(2)O在周期表中位于第2周期,第VIA;
(3)根据元素周期律中原子半径的变化规律,五种元素原子半径由大到小的顺序是E>B>C>D>A;
(4)A、B、C、D可形成一种受热易分解的化合物,该化合物是碳酸氢铵,化学方程式为NH4HCO3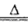 NH3↑+H2O+CO2↑;
NH3↑+H2O+CO2↑;
(5)分子式为C2H2O4的化合物是乙二酸。
考点:考查元素推断,元素位置的判断,原子半径的比较,化学方程式的书写,物质名称的判断

某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | | | | | | |
(2)实验结论: 。
下列化学用语的书写,正确的是
A.氯气的电子式: | B.硫原子的结构示意图: |
C.溴化钠的电子式: | D.质量数为37的氯原子37 17Cl |
下列说法中正确的是( )
| A.分子中键能越大,键长越长,则分子越稳定 |
| B.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| C.PCl5分子中P原子和Cl原子最外层都满足8电子结构 |
| D.用价层电子互斥理论预测H2S和BF3的立体结构,分别为V形和平面正三角形 |
下列说法正确的是
| A.熔化干冰和熔化NaCl晶体所克服的作用力相同 |
| B.氢键比分子间作用力强,所以它属于化学键 |
| C.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| D.冰的密度比水小,这是由于冰中存在氢键所致 |
