题目内容
20.已知化学反应CO(g)+H2O(g)?CO2(g)+H2(g)在500℃下将CO和H2O各0.2mol的气态化合物充入2L的密闭容器中进行反应,达到平衡后,测得c(CO)═0.025mol•L-1,试回答下列问题(1)求该反应在500℃下的平衡常数?
(2)如反应开始时C(H2O)=C(CO)=0.020mol•L-1求CO的转化率.
分析 在500℃下将CO和H2O各0.2mol的气态化合物充入2L的密闭容器中进行反应,达到平衡后,测得c(CO)═0.025mol•L-1,则平衡时CO为2L×0.025mol/L=0.05mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):0.2 0.2 0 0
变化量(mol):0.15 0.15 0.15 0.15
平衡量(mol):0.05 0.05 0.15 0.15
(1)反应前后气体体积不变,用物质的量代替浓度代入平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$计算;
(2)与原平衡相比,等效为降低压强,反应前后气体体积不变,平衡不移动,平衡时反应物转化率相等.
解答 解:在500℃下将CO和H2O各0.2mol的气态化合物充入2L的密闭容器中进行反应,达到平衡后,测得c(CO)═0.025mol•L-1,则平衡时CO为2L×0.025mol/L=0.05mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):0.2 0.2 0 0
变化量(mol):0.15 0.15 0.15 0.15
平衡量(mol):0.05 0.05 0.15 0.15
(1)反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,故平衡常数K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=9,
答:该反应在500℃下的平衡常数为9.
(2)与原平衡相比,等效为降低压强,反应前后气体体积不变,平衡不移动,平衡时反应物转化率相等,故CO的转化率为$\frac{0.15mol}{0.2mol}$×100%=75%,
答:CO的转化率为75%.
点评 本题考查化学平衡计算,注意三段式解题法在化学平衡计算中应用,(2)中注意利用等效平衡进行解答,也可以利用平衡常数进行计算.

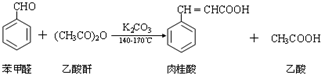
反应物和产物的部分性质如表所示:
| 名称 | 分子量 | 性状 | 密度g/cm3 | 熔点℃ | 沸点℃ | 溶解度:克/100mL溶剂 | ||
| 水 | 醇 | 醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.06 | -26 | 178 | 0.3 | 互溶 | 互溶 |
| 乙酸酐 | 102 | 无色液体 | 1.082 | -73 | 138 | 12 | 溶 | 不溶 |
| 肉桂酸 | 148 | 无色固体 | 1.248 | 133 | 300 | 0.04 | 24 | 溶 |

主要实验步骤:
Ⅰ合成:按图甲连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.0g无水碳酸钾.再加入几粒固体X,控制温度在140~170℃,将此混合物回流45min.
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40mL水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40mL 10%的氢氧化钠水溶液,再加90mL水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、过滤、洗涤、
干燥等操作得到较纯净的肉桂酸4.5克;
请回答下列问题:
(1)固体X的作用是防止暴沸,X的名称是沸石或碎瓷片
(2)图甲装置中冷凝管的作用是冷凝回流,提高原料利用率,减少产物挥发
(3)图乙装置中玻璃管的作用是平衡压强,仪器D的名称是锥形瓶
(4)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥.实验中为控制温度在140~170℃需在BD中加热(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.砂子 D.植物油(沸点230~325℃)
(5)本实验中,肉桂酸的产率为60.8%.
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
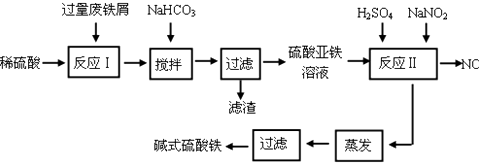
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)如何加快废铁屑的溶解,写出两种办法搅拌、加热.
(2)加入少量NaHCO3的目的是调节pH在4.4-7.5范围内.
(3)反应Ⅱ中加入NaNO2的目的是将亚铁离子氧化为铁离子.
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-.为检验所得产品中是否含有Fe2+,应使用的试剂为C.
A.氯水 B.KSCN溶液 C.酸性KMnO4溶液 D.NaOH溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<2,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL.
已知:2Fe3++2I-═2Fe2++I2 I2+2S2O32-═2I-+S4O62-
则溶液中铁元素的总含量为g/L.若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会偏高 (填“偏高”“偏低”“不变”).
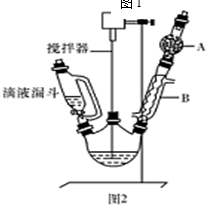
溴苯、乙醚溶液(40℃)苯甲酸乙酯、乙醚溶液、搅拌格氏试剂氯化铵饱和溶液镁条中间物三苯甲醇图1

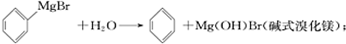
已知:(I)格氏试剂容易水解:
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇,笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴 加热方式.
①溶解、过滤粗产品②洗涤、干燥三苯甲醇
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
| A. | 加入少量CuSO4固体 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量Na2CO3固体 |
 $\stackrel{合适的氧化剂}{→}$
$\stackrel{合适的氧化剂}{→}$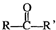 (注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
(注:R、R’为烃基),A为有机合成中间体,在一定条件下发生消去反应,可能得到两种互为同分异构体的产物,其中的一种B可用于制取合成树脂、染料等多种化工产品.A能发生如图所示的变化:
 .
. 或
或 .
.