题目内容
18.下列电离方程式的书写不正确的是( )| A. | NH3•H2O═NH$\stackrel{+}{4}$+OH- | B. | BaSO4═Ba2++SO$\stackrel{2-}{4}$ | ||
| C. | HNO3═H++NO$\overline{3}$ | D. | NaOH═Na++OH- |
分析 A.一水合氨为弱电解质,部分电离,用可逆号;
B.硫酸钡为强电解质,完全电离;
C.硝酸为强电解质,完全电离;
D.氢氧化钠为强电解质,完全电离.
解答 解:A.一水合氨为弱电解质,部分电离,电离方程式:NH3•H2O?NH4++OH-,故A错误;
B.硫酸钡为强电解质,完全电离,电离方程式:BaSO4═Ba2++SO42-,故B正确;
C.硝酸为强电解质,完全电离,电离方程式:HNO3═H++NO3-,故C正确;
D.氢氧化钠为强电解质,完全电离,电离方程式:NaOH═Na++OH-,故D正确;
故选:A.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱是解题关键,注意弱电解质用可逆号,题目难度不大.

练习册系列答案
相关题目
8.下列各组离子在无色酸性溶液中能大量共存的是( )
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO42-、Cl- |
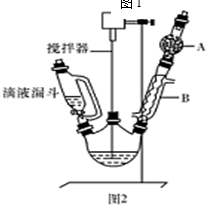
9.三苯甲醇是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示.
溴苯、乙醚溶液(40℃)苯甲酸乙酯、乙醚溶液、搅拌格氏试剂氯化铵饱和溶液镁条中间物三苯甲醇图1

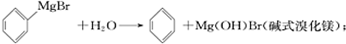
已知:(I)格氏试剂容易水解:
(Ⅱ)相关物质的物理性质如下:
(Ⅲ)三苯甲醇的相对分子质量是260.
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴 加热方式.
①溶解、过滤粗产品②洗涤、干燥三苯甲醇
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
溴苯、乙醚溶液(40℃)苯甲酸乙酯、乙醚溶液、搅拌格氏试剂氯化铵饱和溶液镁条中间物三苯甲醇图1


已知:(I)格氏试剂容易水解:

(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇,笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇,乙醚等有机溶剂 |
请回答以下问题:
(1)装置中玻璃仪器B的名称为冷凝管;装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是平衡压强,使漏斗内液体顺利滴下;制取格氏试剂时要保持温度约为40℃,可以采用水浴 加热方式.
①溶解、过滤粗产品②洗涤、干燥三苯甲醇
(3)制得的三苯甲醇粗产品经过初步提纯,仍含有氯化铵杂质,可以设计如下提纯方案:

其中,洗涤液最好选用a(填字母序号).
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80mL.则产品中三苯甲醇的质量分数为90%.
6.已知298K时,2SO2(g)+O2(g)?2SO3(g)△H=-197kJ•mol-1.在该温度下,向某密闭恒定体积的容器中通入2mol SO2和1mol O2达到平衡时,SO3为0.6mol,如果此时移走1mol SO2和0.5mol O2,在相同温度下再达到平衡时SO3的物质的量是( )
| A. | 0.3mol | B. | 小于0.3mol | ||
| C. | 大于0.3mol,小于0.6mol | D. | 大于0.6mol |
13.下列实验操作不正确的是( )
| A. | 用量筒量取25.0mL蒸馏水 | B. | 用分液漏斗分离乙醇和水 | ||
| C. | 用烧杯溶解FeCl3固体试样 | D. | 用托盘天平称量NaCl固体5.8g |
3.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO${\;}_{3}^{-}$的物质的量浓度之比为3:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
10.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能减慢反应速率但又不影响氢气生成总量的是( )
| A. | 加入少量CuSO4固体 | B. | 加入少量CH3COONa固体 | ||
| C. | 加入少量NH4HSO4固体 | D. | 加入少量Na2CO3固体 |
7.环境污染已经成为我国必须面对的首要社会问题.引起下列环境污染的原因或处理方法中正确的是( )
| A. | 雾霾是由大量燃烧煤、天然气、石油等产生的CO2偏高所致 | |
| B. | 绿色化学的核心是开发应用新技术,加大对环境污染的治理能力 | |
| C. | 用催化氧化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 加酶无磷洗衣粉的使用,可以降低水体污染(如海洋的赤潮) |



