题目内容
【题目】二氯化锡可用于染料、香料、制镜、电镀等工业,是一种重要的化工原料。实验室制备二氯化锡可分三个过程完成,具体实验如下:
已知:①常温下四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃,易溶于水。
②二氯化锡:遇水强烈水解,在浓盐酸中溶解度大且有利于SnCl2·2H2O的生成。
I.四氯化锡的制备。所需装置如图所示:
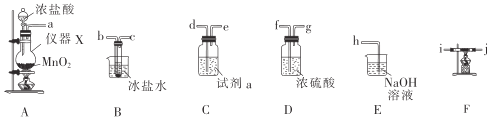
(1)仪器X的名称是___。
(2)试剂a是___,冰盐水的作用是__。
(3)按气流从左到右的顺序连接好装置:a___。
II.SnCl2·2H2O的制备
将装置B中得到的无色液体全部倒入锥形瓶中并加入适量浓盐酸,慢慢加入锡粉直至不能溶解,过滤后即得到SnCl2·2H2O。
(4)加入适量浓盐酸的作用是___。
(5)加入锡粉发生的反应为___。
III.SnCl2·2H2O的脱水,步骤如下:
a.将得到的SnCl2·2H2O置于干燥的50mL烧杯中,加入足量醋酸酐(CH3COOOCCH3)溶解。
b.将烧杯放入通风橱内,约5分钟搅拌一次,30分钟后在干燥的布氏漏斗上过滤。
c.用3~5mL乙醚淋洗产品,将产品转移至表面血,放入干燥器中干燥30分钟后,称重。
(6)SnCl2·2H2O脱水步骤a中加入醋酸酐后得到的有机物的结构简式是___。
(7)设计实验检测制得的SnCl2中是否有SnCl4:___。
【答案】圆底烧瓶 饱和食盐水 冷凝SnCl4 defgijbch或defgjibch 抑制SnCl2的水解 Sn+SnCl4=2SnCl2(或Sn+2HCl+2H2O=SnCl2·2H2O+H2↑) CH3COOH 称量19.0g产品,加入适量稀硝酸酸化,再加入足量AgNO3,充分反应,若得沉淀质量大于28.7g,则说明产品中有SnCl4
【解析】
I.由制备原理及实验装置可知,A中发生MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,然后连接C(试剂为饱和食盐水)可除去氯气中的HCl,再连接D可干燥氯气,然后连接F,F中发生Sn+2Cl2
MnCl2+Cl2↑+2H2O,然后连接C(试剂为饱和食盐水)可除去氯气中的HCl,再连接D可干燥氯气,然后连接F,F中发生Sn+2Cl2 ![]() SnCl4,连接B可冷凝分离出SnCl4,最后连接E可吸收尾气;
SnCl4,连接B可冷凝分离出SnCl4,最后连接E可吸收尾气;
II.SnCl2溶液易水解,在浓盐酸中溶解度大且有利于SnCl22H2O的生成,在B中加Sn反应生成SnCl2(或SnCl22H2O);
III.由实验可知SnCl22H2O脱水,利用醋酸酐脱水生成乙酸和SnCl2;SnCl2、SnCl4中Cl元素的质量分数不同,可检测混合物中Cl元素的含量判断SnCl2中是否有SnCl4。
(1)根据图示,仪器X是圆底烧瓶,故答案为:圆底烧瓶;
(2)浓盐酸易挥发,制得的氯气中会含有氯化氢杂质,试剂a是除去氯气中的氯化氢杂质的,应该选用饱和食盐水;常温下四氯化锡是无色易流动的液体,冰盐水可以冷凝SnCl4,故答案为:饱和食盐水;冷凝SnCl4;
(3)由上述分析可知,装置的连接顺序为A→C→D→F→B→E,且导管长进短出,则按气流从左到右的顺序连接好装置:adefgijbch或adefgjibch,故答案为:defgijbch或defgjibch;
(4)二氯化锡遇水强烈水解,在浓盐酸中溶解度大且有利于SnCl2·2H2O的生成,因此加入适量浓盐酸可以抑制SnCl2的水解,故答案为:抑制SnCl2的水解;
(5)加入锡粉发生的反应为Sn+SnCl4=2SnCl2(或Sn+2HCl+2H2O=SnCl22H2O+H2↑),故答案为:Sn+SnCl4=2SnCl2(或Sn+2HCl+2H2O=SnCl22H2O+H2↑);
(6)SnCl22H2O脱水步骤a中加入醋酸酐,醋酸酐是用来脱水的,醋酸酐与水反应生成的有机物是CH3COOH,故答案为:CH3COOH;
(7)由于![]() 、
、![]() 两者所含
两者所含![]() 元素的质量分数不同,可以通过测量一定质量的混合物中的
元素的质量分数不同,可以通过测量一定质量的混合物中的![]() 的含量进行推断,具体方法为:称量19.0g(0.1mol
的含量进行推断,具体方法为:称量19.0g(0.1mol![]() )产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g(0.2molAgCl),则说明产品中有SnCl4,故答案为:称量19.0g产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g,则说明产品中有SnCl4。
)产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g(0.2molAgCl),则说明产品中有SnCl4,故答案为:称量19.0g产品,加入适量稀硝酸酸化,再加入足量硝酸银,充分反应,若得沉淀质量大于28.7g,则说明产品中有SnCl4。