题目内容
10.25℃时,将水不断滴入0.1mol/L的醋酸中,随着V(H2O)的增大,可以表示X的是( )
| A. | 溶液的导电性 | B. | c(H+) | C. | ka(CH3COOH) | D. | $\frac{c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$ |
分析 醋酸是弱酸,加水稀释时促进电离,但氢离子浓度和醋酸根离子浓度随加水量的增多而减小,离子浓度减小,溶液导电性减弱,温度不变,醋酸的电离平衡常数不变,据此分析.
解答 解:A、醋酸是弱酸,加水稀释时促进电离,但氢离子浓度和醋酸根离子浓度随加水量的增多而减小,离子浓度减小,溶液导电性减弱,故A错误;
B、醋酸是弱酸,加水稀释时促进电离,但氢离子浓度和醋酸根离子浓度随加水量的增多而减小,故B错误;
C、温度不变,醋酸的电离平衡常数不变,故C错误;
D、温度不变,醋酸的电离平衡常数不变,ka(CH3COOH)=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$不变,但醋酸根离子浓度减小,所以$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$增大,符合图示,故D正确;
故选D.
点评 本题考查了醋酸加水稀释时各离子浓度的变化,注意电离平衡常数的大小只受温度影响,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
19.下列反应的离子方程式,正确的是( )
| A. | Fe2O3溶于过量的氢酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |

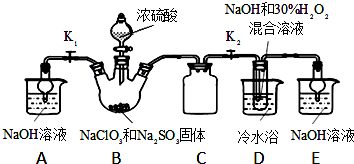
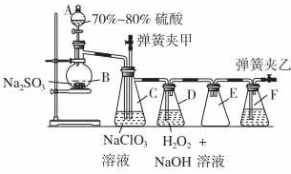 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用下列装置(略去部分夹持仪器)制备少量的亚氯酸钠.