题目内容
4.将11gFe、Al混合物投入到200mL6.0mol/盐酸中,充分反应,固体完全溶解,共得到标准状态的H28.96L.假设反应前后溶液的体积不变.求:(1)反应中转移的电子总数;
(2)最后所得溶液中溶质的物质的量浓度.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量,结合H元素化合价变化计算转移电子数目;
(2)假设Fe、Al物质的量分别为xmol、ymol,根据二者总质量、电子转移守恒列方程计算Fe、Al物质的量,由原子守恒可得FeCl2、AlCl3物质的量,根据c=$\frac{n}{V}$计算二者物质的量浓度,根据H原子守恒判断HCl是否完全反应,若有剩余,进而计算反应后溶液中HCl浓度.
解答 解:(1)标况下,氢气物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,由H元素化合价变化,可知转移电子数目为0.4mol×2×6.02×1023mol-1=4.816×1023,
答:转移电子数目为4.816×1023;
(2)假设Fe、Al物质的量分别为xmol、ymol,根据二者总质量、电子转移守恒,则:
$\left\{\begin{array}{l}{56x+27y=11}\\{2x+3y=0.4×2}\end{array}\right.$
解得x=0.1、y=0.2,
则n(FeCl2)=n(Fe)=0.1mol,则c(FeCl2)=$\frac{0.1mol}{0.2L}$=0.5mol/L;
n(AlCl3)=n(Al)=0.2mol,c(AlCl3)=$\frac{0.2mol}{0.2L}$=1mol/L,
原盐酸中n(HCl)=0.2L×4mol/L=0.8mol,生成0.4mol氢气需要0.8molHCl,则HCl也恰好完全反应,
答:最后所得溶液中FeCl2为0.5mol/L、AlCl3为1mol/L.
点评 本题考查化学方程式计算、混合物计算,题目利用守恒法解答,较好的考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
15.下列四项都能导电,其中一项与其他三项导电原理不同的是( )
| A. | 氯化钠熔化导电 | B. | 液态汞导电 | ||
| C. | H2SO4溶液导电 | D. | 熔融状态的K0H导电 |
19.下列反应的离子方程式,正确的是( )
| A. | Fe2O3溶于过量的氢酸碘中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+CO32- | |
| C. | 向漂白粉溶液中通入SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
4.在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)?mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)m=2,表中b<c(填“<”、“=”或“>”).
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度>0.09mol/L(填“<”、“=”或“>”).
(3)在80℃时该反应的平衡常数K值为0.5(保留1位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时①②④.
①A的转化率越高 ②A与B的浓度之比越大 ③B的产量越大 ④正反应进行的程度越大.
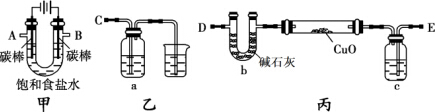 某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.
某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电解率.