题目内容
20.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ/mol).如表是一些键能数据:| 化学键 | C-H | C-F | H-F | F-F | H-H | H-N |
| 键 能 | 414 | 489 | 565 | 158 | 436 | 391 |
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
分析 (1)旧键断裂吸收的能量减去新键生成释放的能量值即为反应热,依据化学反应的焓变=反应物总键能-生成物总键能计算得到反应的焓变;
(2)1molN2含有1molN≡N,1molH2含有1molH-H,1molNH3含有3molN-H,依据△H=反应物的总键能-生成物的总键能进行计算.
解答 解:(1)化学反应的焓变=反应物总键能-生成物总键能,CH4(g)+4F2(g)=CF4(g)+4HF(g)△H=(414KJ/mol×4+158KJ/mol×4)-(489KJ/mol×4+565KJ/mol×4)=-1928KJ/mol;
故答案为:-1928KJ/mol;
(2)已知:H-H键能为436kJ/mol,N-H键键能为391kJ/mol,令N≡N键的键能为x,
对于反应$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,
反应热=反应物的总键能-生成物的总键能,故△H=$\frac{1}{2}$xkJ/mol+$\frac{3}{2}$×436kJ/mol-3×391=-46kJ/mol,解得:x=946kJ/mol,
故答案为:946kJ/mol.
点评 本题考查反应热的有关计算,掌握反应热与键能的关系是解答关键,题目难度不大,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.根据四个H2O2参与的化学方程式判断下列说法正确的是( )
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
①Na2O2+2HCl=2NaCl+H2O2
②Ag2O+H2O2=2Ag+O2↑+H2O
③2H2O2=2H2O+O2↑
④3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O.
| A. | 上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是Ag2O>H2O2>K2CrO4 | |
| B. | H2O2既体现氧化性又体现还原性的反应是①③ | |
| C. | H2O2仅体现氧化性的反应是② | |
| D. | H2O2仅体现还原性的反应是③ |
6.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 28g由C2H4和C3H6组成的混合物中含有氢原子的数目为4NA | |
| B. | 1mol甲基含有的电子数为10NA | |
| C. | 6.0g冰醋酸与4.6g乙醇反应生成乙酸乙酯的分子数为0.1NA | |
| D. | 标准状况下,4.48L CHCl3中分子数为0.2NA |
5.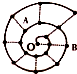 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )| A. | 同一虚线相连的元素离O点越远的原子半径越大 | |
| B. | A、B处于同一周期 | |
| C. | A元素是图中非金属性最强的元素 | |
| D. | A、B组成的化合物中不可能含有共价键 |
9.下列说法中,不正确的是( )
| A. | 与煤相比,天然气是较清洁的化石燃料 | |
| B. | 煤的干馏和石油的分馏都是物理变化 | |
| C. | 煤燃烧产生的硫氧化物和氮氧化物是形成酸雨的主要物质 | |
| D. | 苯可从煤焦油中提取,它是广泛应用的化工原料,有特殊气味,有毒 |
10.某小组为研究原电池原理,设计如图装置.下列叙述正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b用导线连接时,电子由a流向b | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
 某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写:
某温度下,在2L容器中X、Y、Z三种气体的物质的量(n)随着时间的(t)变化的曲线如图所示.由图中数据分写: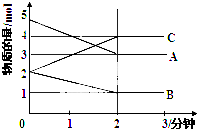 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.