题目内容
5.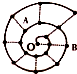 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”一种元素,其中O点代表氢元素,下列说法中正确的是( )| A. | 同一虚线相连的元素离O点越远的原子半径越大 | |
| B. | A、B处于同一周期 | |
| C. | A元素是图中非金属性最强的元素 | |
| D. | A、B组成的化合物中不可能含有共价键 |
分析 0点代表氢元素,按照原子序数由小到大由里往外延伸,由图可知,O、B连线的三元素为第ⅠA族,A为O元素,B为Na元素,根据元素的种类可知虚线相连的元素处于同一族,结合对应元素的性质解答该题.
解答 解:A.虚线相连的元素处于同一族,原子序数大的原子半径大,则同一虚线相连的元素离O点越远的原子半径越大,故A正确;
B.A为O元素,B为Na元素,分别为二、三周期元素,故B错误;
C.F元素的非金属性最强,故C错误;
D.A、B组成的化合物过氧化钠中含氧原子之间的非极性共价键,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,侧重于学生的分析能力的考查,题目考查新颖,贴近高考,有利于培养学生的良好的科学素养,提高学习的积极性,看懂图象推断元素是解题的关键,注意对元素周期表的整体把握,题目难度不大.

练习册系列答案
相关题目
10.下列有关σ键和π键的说法错误的是( )
| A. | 在某些分子中,化学键可能只有π键而没有σ键 | |
| B. | 当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键 | |
| C. | σ键的特征是轴对称,π键的特征是镜面对称 | |
| D. | 含有π键的分子在反应时,π键是化学反应的积极参与者 |
13.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 1 mol NH2- 含有9 NA个电子 | |
| B. | 1.8 g的NH4+离子中含有的电子总数为NA | |
| C. | 0℃时,44.8L SO3含有的氧原子数为6 NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
20.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ/mol).如表是一些键能数据:
(1)根据键能数据计算以下反应的反应热:CH4(g)+4F2(g)═CF4(g)+4HF(g);△H=-1928KJ/mol.
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
| 化学键 | C-H | C-F | H-F | F-F | H-H | H-N |
| 键 能 | 414 | 489 | 565 | 158 | 436 | 391 |
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
10.下列实验操作与预期的目的或所得实验结论一致的是( )
| 选项 | 实验操作 | 实验目的或结论 |
| A | C2H5OH浓硫酸170℃共热, 制得气体通入酸性KmnO4溶液 | 检验制得气体是否为乙烯 |
| B | 向含有少量的FeBr2和FeCl2溶液中 加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| C | 在淀粉溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 银氨溶液中滴入少量组成为C2H4O2的液态 有机物,水溶微热,有银镜出现 | 不能确定该有机物一定是甲酸甲酯 |
| A. | A | B. | B | C. | C | D. | D |
14.用铁片和稀硫酸反应制取氢气时,下列做法能加快化学反应速率的是( )
| A. | 降低温度 | B. | 增大铁片的质量 | ||
| C. | 用铁粉代替铁片 | D. | 用98%的浓硫酸替代稀硫酸 |
15.工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O2?2SO3(正反应放热),下列有关说法正确的是( )
| A. | 升高温度只提高逆反应速率 | B. | 降低温度正、逆反应速率都降低 | ||
| C. | 催化剂只会增大反应速率 | D. | 减小压强时只是逆反应速率降低 |
 .
. ,E离子的电子排布式为1s22s22p6,B原子的电子排布图为
,E离子的电子排布式为1s22s22p6,B原子的电子排布图为 .
.