题目内容
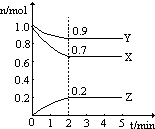
12.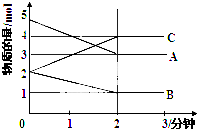 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示,容器的体积为2L.由图中数据分析,反应开始至2min,C的平均反应速率为0.5mol/(L•min).化学方程式为2A+B?2C.
分析 根据v=$\frac{△C}{△t}$进行分析求解;在反应中减小的物质为反应物,增加的物质为生成物,各物质的物质的量的变化量之比等于反应中各物质的计量数之比,写出化学方程式,据此答题.
解答 解:根据v=$\frac{△C}{△t}$=$\frac{\frac{4mol-2mol}{2L}}{2min}$=0.5mol/(L•min),由图可知,在2min时,A的物质的量减小5mol-3mol=2mol,B的物质的量减小2mol-1mol=1mol,A、B为反应物,C的物质的量增加4mol-2mol=2mol,C为生成物,根据反应中的计量数之比等于变化的物质的物质的量之比,要写出反应方程式为:2A+B?2C,
故答案为:0.5mol/(L•min); 2A+B?2C.
点评 本题主要考查了根据图象写化学方程式,比较简单,解题关键就是运用变化量之比等于计量数之比.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
20.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ/mol).如表是一些键能数据:
(1)根据键能数据计算以下反应的反应热:CH4(g)+4F2(g)═CF4(g)+4HF(g);△H=-1928KJ/mol.
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
| 化学键 | C-H | C-F | H-F | F-F | H-H | H-N |
| 键 能 | 414 | 489 | 565 | 158 | 436 | 391 |
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
4.下图是部分周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素,下列说法正确的是( )
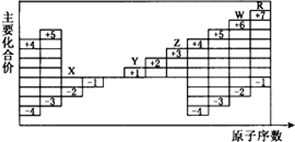

| A. | 五种元素中有三种属于非金属元素,且三种非金属元素均存在同素异形现象 | |
| B. | 五种元素中有两种属于金属元素,且两种金属元素均不能在空气中稳定存在 | |
| C. | 五种元素的单质在固态时分别属于三种不同的晶体类型 | |
| D. | Y、Z、W三种元素的最高价氧化物的水化物相互之间均能发生反应 |
1.对于如图的有机物,下列说法中正确的是( )
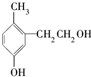

| A. | 它是苯酚的同系物 | |
| B. | 1mol该有机物能与2 mol溴水发生取代反应 | |
| C. | 1mol该有机物能与金属钠反应产生0.5 mol H2 | |
| D. | 1mol该有机物能与2 mol NaOH反应 |
2.下列分子中,碳原子全部以sp杂化轨道成键的是( )
| A. | 乙烷 | B. | 乙炔 | C. | 苯 | D. | 乙醛 |
 .
.
 ,E离子的电子排布式为1s22s22p6,B原子的电子排布图为
,E离子的电子排布式为1s22s22p6,B原子的电子排布图为 .
.