题目内容
10.某小组为研究原电池原理,设计如图装置.下列叙述正确的是( )
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b用导线连接时,电子由a流向b | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
分析 铁比铜活泼,可置换铜,形成原电池反应时,铁为负极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,以此解答.
解答 解:A.a和b不连接时,铁和铜离子发生置换反应而发生化学腐蚀,故A正确;
B.a和b用导线连接时,铁片上发生的反应为Fe-2e-=Fe2+,故B错误;
C.Fe比铜活泼,形成原电池反应时Fe为负极,则电子由b流向a,故C错误;
D.无论a和b是否连接,铁片均会溶解,都生成亚铁离子,溶液由蓝色变为浅绿色,故D正确.
故选AD.
点评 本题考查原电池知识,为高频考点,侧重于学生分析能力和基本理论的理解和运用的考查,注意把握金属的活泼性强弱以及电极方程式的书写,难度不大.

练习册系列答案
相关题目
20.常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ/mol).如表是一些键能数据:
(1)根据键能数据计算以下反应的反应热:CH4(g)+4F2(g)═CF4(g)+4HF(g);△H=-1928KJ/mol.
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
| 化学键 | C-H | C-F | H-F | F-F | H-H | H-N |
| 键 能 | 414 | 489 | 565 | 158 | 436 | 391 |
(2)根据键能和反应热化学方程式$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)═NH3(g);△H=-46KJ/mol,则N=N的键能为946kJ/mol.
1.对于如图的有机物,下列说法中正确的是( )
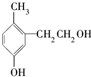

| A. | 它是苯酚的同系物 | |
| B. | 1mol该有机物能与2 mol溴水发生取代反应 | |
| C. | 1mol该有机物能与金属钠反应产生0.5 mol H2 | |
| D. | 1mol该有机物能与2 mol NaOH反应 |
18.已知反应2HI(g)?H2(g)+I2(g)△H=+11kJ•mol-1,1molH2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)中化学键断裂时需吸收的能量(kJ)为( )
| A. | 598 | B. | 576 | C. | 288 | D. | 299 |
5.下列说法正确的是( )
| A. | 2-丁醇发生消去反应产物有2 种 | B. | 卤代烃都能发生水解反应 | ||
| C. | 醇在Cu/△条件下都能氧化成醛 | D. | 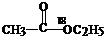 在酸性条件下水解产物是 在酸性条件下水解产物是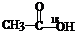 和C2H5OH 和C2H5OH |
15.工业制硫酸中的一步重要反应是SO2的催化氧化:2SO2+O2?2SO3(正反应放热),下列有关说法正确的是( )
| A. | 升高温度只提高逆反应速率 | B. | 降低温度正、逆反应速率都降低 | ||
| C. | 催化剂只会增大反应速率 | D. | 减小压强时只是逆反应速率降低 |
2.下列分子中,碳原子全部以sp杂化轨道成键的是( )
| A. | 乙烷 | B. | 乙炔 | C. | 苯 | D. | 乙醛 |
19.下列做法利用了浓度对化学反应速率的影响的是( )
| A. | 将食物保存在电冰箱里 | |
| B. | 做粉尘爆炸实验时选用很细的面粉 | |
| C. | 向过氧化氢溶液中加入MnO2 | |
| D. | 铁与稀盐酸反应太慢时加入较浓的盐酸 |
20.下列说法正确的是( )
| A. | 离子晶体中可能含有共价键,但不一定含有金属元素 | |
| B. | 分子晶体中一定含有共价键 | |
| C. | 非极性分子中一定存在非极性键 | |
| D. | 对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔、沸点越高 |