题目内容
【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
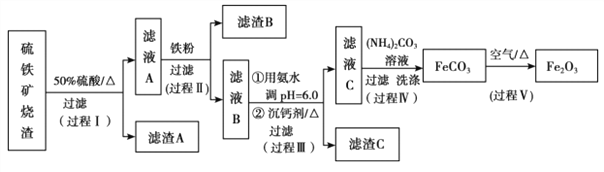
已知:生成氢氧化物的 pH 如下表所示
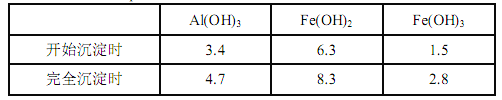
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
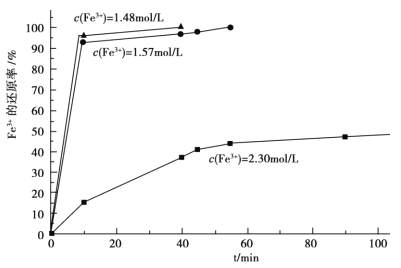
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
【答案】 SiO2 Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ c(Fe3+)在1.60mol/L左右时,反应速率更快,Fe3+的还原率更高 CaF2、Al(OH)3 温度过高,(NH4)2CO3易分解 4FeCO3+O2![]() 2Fe2O3+4CO2↑
2Fe2O3+4CO2↑
【解析】试题分析:由题中流程可知,烧渣在加热的条件下经硫酸浸取后,过滤除去不溶物二氧化硅后,向滤液A中加入足量铁粉把Fe3+还原为Fe2+,过滤得滤液B,向滤液B中加入氨水调到pH=6.0,使Al3+完全转化为氢氧化铝沉淀,然后加入沉淀剂并加热,待滤液中Ca2+完全沉淀后过滤,向滤液C中加入碳酸铵溶液,过滤、洗涤,得到碳酸亚铁,最后将碳酸亚铁在空气中加热得到氧化铁。
(1)浇渣中只有SiO2不溶于硫酸,故滤渣 A 的主要成分是SiO2。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。该过程共有两个离子反应发生,其离子方程式为Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑。
(3)由Fe3+浓度、还原率和反应时间的关系曲线可知,c(Fe3+)在1.60mol/L左右时,反应速率更快(在很短的时间内达到很高的还原率),Fe3+的还原率更高,故课题组选择稀释后c(Fe3+)为 1.60mol/L左右。
(4)由表中实验数据可知,在相同的条件下,选择NH4F作为沉钙剂时,滤液B中钙的含量最低,故应选择NH4F作为沉钙剂,得到滤渣 C 的主要成分有CaF2、Al(OH)3。
(5)在过程Ⅳ中,使用了碳酸铵作为沉淀剂,反应温度需要控制在35℃以下,不宜过高,其可能的原因是:温度过高,(NH4)2CO3易分解。
(6)在过程Ⅴ中,碳酸亚铁在空气中加热得到氧化铁,反应的化学方程式是4FeCO3+O2![]() 2Fe2O3+4CO2↑ 。
2Fe2O3+4CO2↑ 。

【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应化学平衡常数的表达式:K=_______________________________;
(2)该反应为________(填“吸热”或“放热”)反应;
(3)下列说法中能说明该反应达平衡状态的是__________
A、容器中压强不变
B、混合气体中c(CO)不变
C、混合气体的密度不变
D、c(CO) = c(CO2)
E、单位时间内生成CO的分子数与生成H2O的分子数相等
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为__________℃。