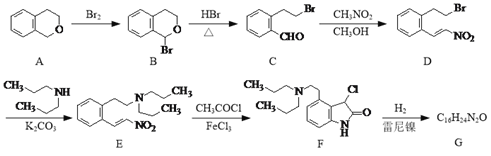
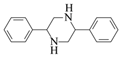
题目内容
【题目】(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-转化为Cr3+,其电极反应式为______________________________________。
(2)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。与汽油相比,氢气作为燃料的优点是_____________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:__________________________________。
(3)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是_____________________________。
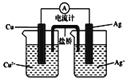
(4)右图所示原电池正极的反应式为___________________________。
【答案】 Cr2O72-+14H++6e-==2Cr3++7H2O 污染小,可再生,来源广,资源丰富,燃烧热值高 H2+2OH--2e-===2H2O FeS2+4Li++4e-===Fe+2Li2S(或FeS2+4e-===Fe+2S2-) Ag++e-===Ag
【解析】(1)铁炭混合物在水溶液中可形成许多微电池。将含有Cr2O72-的酸性废水通过铁炭混合物,在微电池正极上Cr2O72-获得电子,被还原产生Cr3+,则正极上发生的电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O;(2)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O;(3)电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极发生还原反应,所以是二硫化亚铁得到电子生成铁和硫离子,电极反应式为:FeS2+4e-=Fe+2S2-。(4)铜的金属性强于银,铜是负极,银是正极,正极的反应式为Ag++e-=Ag。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
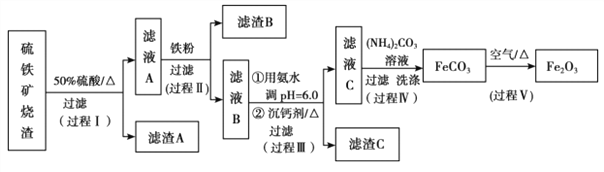
已知:生成氢氧化物的 pH 如下表所示
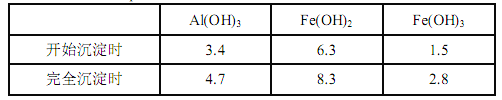
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
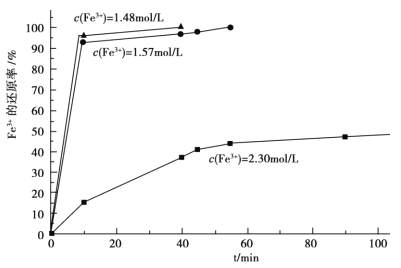
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。