题目内容
2.下列物质的水溶液中,加入Ba(OH)2溶液后,原溶液中阴、阳离子都减少的是( )| A. | CuSO4 | B. | Ca(NO3)2 | C. | Na2CO3 | D. | FeCl3 |
分析 Ba(OH)2在溶液中电离产生钡离子、氢氧根离子,则与选项中的阴、阳离子均发生化学反应,则会导致选项中的原溶液中阴、阳离子都减少,以此来解答.
解答 解:A、铜离子与氢氧根离子生成氢氧化铜沉淀、硫酸根离子与钡离子生成了硫酸钡生成,导致溶液中的阴阳离子都减少,故A错误;
B、氢氧根离子与硝酸钙中的钙离子反应生成了微溶物氢氧化钙,阳离子减少,但是阴离子不变,故B错误;
C、钡离子与碳酸根离子反应,则只能使阴离子浓度减小,故C正确;
D、氢氧根离子与铁离子反应,则只能使阳离子浓度减小,故D错误;
故选A.
点评 本题考查了离子的共存问题,熟悉离子之间的反应是解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列关于氧化还原反应中电子转移数目的判断不正确的是( )
| A. | 5.6g铁粉与氯气充分反应失去的电子数一定为0.3NA | |
| B. | 0.1mol Zn与含0.1mol HCl的盐酸充分反应,转移的电子数目为0.2NA | |
| C. | 1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移的电子数为NA | |
| D. | 向FeCl2溶液中通入Cl2,当有1molFe2+被氧化时,共转移的电子的数目为NA |
17.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,用强碱处理并没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | 配合物中心原子的电荷数和配位数均为6 | |
| B. | 该配合物可能是平面正方形结构 | |
| C. | Cl-和NH3分子均参与配位 | |
| D. | Cl-没有孤对电子,NH3有孤对电子 |
11.已知:H+H→H2 过程放出437.6kJ热量,下列说法正确的是( )
| A. | 氢气分子内每个氢原子都达到8电子稳定结构 | |
| B. | 相同条件下1mol H2的能量比2mol H的能量低 | |
| C. | 1mol H2离解成2mol H要放出437.6kJ热量 | |
| D. | 氢原子比氢分子性质更稳定 |
12.已知NH4CuSO3与足量的10mol/L硫酸混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色.据此判断下列说法正确的是( )
| A. | 刺激性气味的气体是氨气 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 1 mol NH4CuSO3完全反应转移0.5 mol电子 | |
| D. | 反应中硫酸作氧化剂 |
 氮是地球上极为丰富的元素.
氮是地球上极为丰富的元素.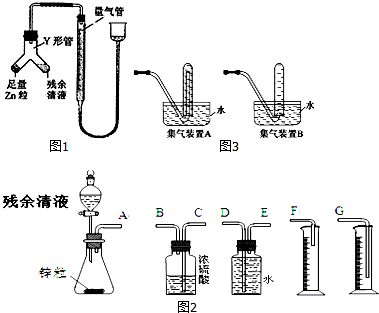
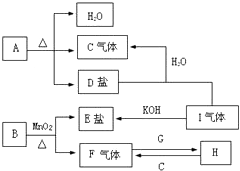 已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题:
已知A、B、C、D、E、F、G、H、I九种物质,A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G是一种单质,I是一种化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答下列问题: