题目内容
7.化学和材料开发制造、科学研究、生产生活等密切相关.(1)第十八届江苏省运动会于2014年9月19日在徐州奥体中心开幕,奥体中心建筑采用了世界领先的钢结构技术,建筑材料中还使用了大量的铝合金、玻璃等.
①工业上铁的冶炼是在高炉中进行的,主要原料有铁矿石,焦炭、空气、石灰石等.
②下列有关铝合金性能的叙述正确的是c(填字母).
a.密度大 b.强度小 c.耐腐蚀
③下列物质中,不是工业上制造玻璃的主要原料的是a(填字母).
a.水玻璃 b.二氧化硅 c.碳酸钠
(2)化工生产和科学研究中,经常需要配制一定物质的量浓度的溶液.
①在实验室,使用容量瓶来准确配制一定体积、一定浓度的溶液.
②欲配制1.00mol/L的氯化钠溶液100mL,用不到的仪器是分液漏斗(填“烧杯”、“玻璃棒”或“分液漏斗”).配制500mL0.l mol/L氢氧化钠溶液需要氢氧化钠的质量是2.0g.
③在溶液稀释前后,溶液的体积发生了变化,但溶液中溶质的物质的量不变.配制一定物质的量浓度的Na2CO3溶液时,下列操作正确的是a(填字母).
a.将称好的固体在烧杯中溶解,所得溶液冷至室温再转移到容量瓶中
b.定容时,如果加水超过了刻度线,用胶头滴管直接吸出多余的部分
c.定容摇匀后发现溶液液面低于刻度线,再补加少量蒸馏水至刻度线
(3)物质的结构决定物质的性质,物质的性质关系到物质的用途.
①以电解饱和食盐水为基础制备氯气等产品的工业称为氯碱工业.在实验室要将氯化钠溶液和氯化钾溶液区别开来,可以采用的方法是焰色反应.
②当分散剂是水或其他液体时,根据分散质微粒直径大小的不同,可以将分散系分为浊液、胶体和溶液.在实验室区分胶体与溶液常用的一种物理方法为丁达尔现象.
③在生产中,人们曾用浓氨水来检验氯气管道是否漏气.如果氯气管道某处漏气,用浓氨水检查时就会产生白烟的现象,又知此时发生的是有氮气生成的置换反应,则此时发生反应的化学方程式为8NH3+3Cl2=N2+6NH4Cl.
分析 (1)①工业用高炉炼铁的方法冶炼铁;原料有铁矿石,焦炭、空气、石灰石等;
②铝合金密度小,强度大,耐腐蚀;
③制造玻璃的主要原料二氧化硅、纯碱等;
(2)①容量瓶可用于配制一定体积,浓度的溶液;
②配制溶液常用到烧杯、量筒、玻璃棒、胶头滴管、容量瓶等仪器,根据n=cV=$\frac{m}{M}$计算;
③溶液稀释前后,溶质的物质的量不变,配制溶液时,应将溶液冷至室温再转移到容量瓶中;
(3)①工业用电解饱和食盐水的方法制备氯气,可用颜色反应鉴别氯化钠、氯化钾;
②浊液、胶体和溶液的分散质微粒直径大小不同,胶体具有丁达尔效应;
③氯气和氨气发生氧化还原反应生成氮气和氯化铵.
解答 解:(1)①工业用高炉炼铁的方法冶炼铁;原料有铁矿石,焦炭、空气、石灰石等,故答案为:高炉;石灰石;
②铝合金密度小,强度大,耐腐蚀,故答案为:c;
③制造玻璃的主要原料二氧化硅、纯碱等,水玻璃的主要成分为硅酸钠的水溶液,故答案为:a;
(2)①容量瓶具有不同的规格,不同规格的容量瓶配制不同的体积的溶液,则可用于配制一定体积,浓度的溶液,故答案为:一定体积;
②配制溶液常用到烧杯、量筒、玻璃棒、胶头滴管、容量瓶等仪器,而分液漏斗是用于分液的仪器,
配制500mL0.l mol/L氢氧化钠溶液,需要氢氧化钠的物质的量为0.1mol/L×0.5L=0.05mol,质量是0.05mol×40g/mol=2.0g,
故答案为:分液漏斗; 2.0;
③溶液稀释前后,溶质的物质的量不变,
a.将称好的固体在烧杯中溶解,所得溶液冷至室温再转移到容量瓶中,可防止误差偏大,为正确操作,故a正确;
b.定容时,如果加水超过了刻度线,用胶头滴管直接吸出多余的部分,会导致溶液浓度偏小,故b错误;
c.定容摇匀后发现溶液液面低于刻度线,再补加少量蒸馏水至刻度线,会导致浓度偏小,故c错误;
故答案为:溶质;a;
(3)①工业用电解饱和食盐水的方法制备氯气,哪的焰色反应为黄色,钾的焰色反应为紫色,可用颜色反应鉴别氯化钠、氯化钾,故答案为:饱和食盐水;焰色反应;
②浊液、胶体和溶液的分散质微粒直径大小不同,胶体具有丁达尔效应,故答案为:分散质微粒;丁达尔现象;
③氯气和氨气发生氧化还原反应生成氮气和氯化铵,反应的化学方程式为8NH3+3Cl2=N2+6NH4Cl,故答案为:8NH3+3Cl2=N2+6NH4Cl.
点评 本题多角度考查化学知识,为高考常见题型,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,注意相关基础知识的积累,难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | Na2O2 Na2O | B. | KClO NaOH | C. | Br2 HBr | D. | HF H2O |
| 晶体 | NaCl | MgO | AlBr3 | SiCl4 | 共价化合物R |
| 熔点(℃) | 801 | 2852 | 97.5 | -70 | 1723 |
| 沸点(℃) | 1413 | 3600 | 263.3 | 57 | 2230 |
| A. | SiCl4是分子晶体 | B. | MgO比NaCl的晶格能大 | ||
| C. | R是原子晶体 | D. | AlBr3为离子晶体 |
| A. | CuSO4 | B. | Ca(NO3)2 | C. | Na2CO3 | D. | FeCl3 |
| A. | 两元素形成的最高价氧化物水化物的酸性A强于B | |
| B. | A的气态氢化物比B的气态氢化物稳定 | |
| C. | A的金属性比B的金属性强 | |
| D. | A的阴离子比B的阴离子还原性弱 |
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 4:1 |
| A. | 乙醇和乙酸是常用调味品的主要成分 | |
| B. | 75%(体积分数)的乙醇溶液常用于医疗消毒 | |
| C. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| D. | 制作航天服的聚酯类纤维环和光导纤维都是新型无机非金属材料 |
| A. | 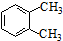 邻二甲苯 邻二甲苯 | B. | 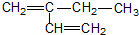 2-乙基-1,3-丁二烯 2-乙基-1,3-丁二烯 | ||
| C. | 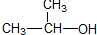 1-甲基乙醇 1-甲基乙醇 | D. |  3,4-二甲基己烷 3,4-二甲基己烷 |
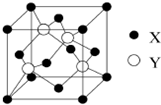 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1.元素Y基态原子的3p轨道上有5个电子.元素Z的原子最外层电子数是其内层的3倍.元素W基态原子核外电子共有16种运动状态.