题目内容
将等物质的量的A、B、C、D四种物质混合放入V L密闭容器中,发生如下反应:aA+bB cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
(1)该化学方程式中,各物质的化学计量数分别为:a= ,b= ,c= ,d= 。
(2)以B的浓度变化表示的该化学反应的速率为v(B)= 。
 cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了n/2 mol,C增加了3n/2 mol,D增加了n mol。此时反应达到平衡。(1)该化学方程式中,各物质的化学计量数分别为:a= ,b= ,c= ,d= 。
(2)以B的浓度变化表示的该化学反应的速率为v(B)= 。
(1)2 1 3 2
(2)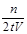 mol·(L·min)-1
mol·(L·min)-1
(2)
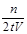 mol·(L·min)-1
mol·(L·min)-1(1)反应转化的各物质的物质的量之比为n(A)∶n(B)∶n(C)∶n(D)="n" mol∶n/2 mol∶3n/2 mol∶n mol=2∶1∶3∶2。
(2)v(B)=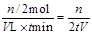 mol·(L·min)-1
mol·(L·min)-1
(2)v(B)=
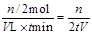 mol·(L·min)-1
mol·(L·min)-1
练习册系列答案
相关题目
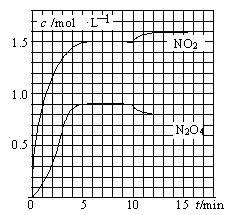
 2NO2(g)
2NO2(g)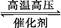 2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )
2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( ) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
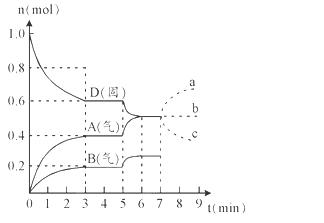
 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表: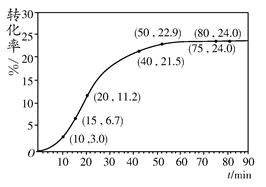


 PCl5(g),5 min末达到平衡,有关数据如表。
PCl5(g),5 min末达到平衡,有关数据如表。