题目内容
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
下列说法中不正确的是
A.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
B.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
C.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
 4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:| 时间/s | 0 | 500 | 100 0 | 150 0 |
| c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
A.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
B.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
C.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
A
试题分析:A.由于该反应的正反应是个气体体积增大的吸热反应。所以根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。对该反应来说就是是个温度,化学平衡向正反应方向移动。平衡越正向移动,生成物的浓度就越大,反应物的浓度就越小,所以平衡常数就越大。因此T1>T2,则K1>K2。错误。B.500 s内N2O5分解速率为(5.00-3.52)mol/L÷500s=2.96╳10-3mol/( L·s).正确。C.假设N2O5分解浓度为2X,则达到平衡时c(N2O5)=(5.00-2X)mol/L;c(NO2)="4X;" c(O2)=X;根据平衡常数的定义式可得
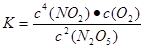 。解得2X=2.5mol/L.因此平衡时N2O5的转化率为50%。正确。D. 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,即增大了压强,假如平衡不发生移动,c(N2O5)是原来的2倍,也就是5.00 mol/L.而增大压强,化学平衡逆向移动,c(N2O5)增大,所以c(N2O5)> 5.00 mol/L.正确。
。解得2X=2.5mol/L.因此平衡时N2O5的转化率为50%。正确。D. 达平衡后其他条件不变,将容器的体积压缩到原来的1/2,即增大了压强,假如平衡不发生移动,c(N2O5)是原来的2倍,也就是5.00 mol/L.而增大压强,化学平衡逆向移动,c(N2O5)增大,所以c(N2O5)> 5.00 mol/L.正确。
练习册系列答案
相关题目
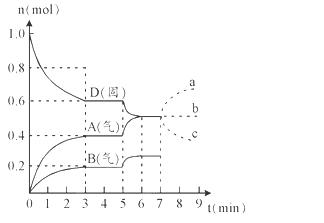
 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
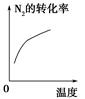
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B) 2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。
2NH3(g);ΔH<0,下列研究目的和示意图相符的是 ( )。

 C(g),经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是
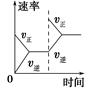
C(g),经过一段时间后达到平衡。反应过程中测定的部分数据如表,下列说法正确的是 2NH3(g)。在相同时间内表示该反应速率最快的是
2NH3(g)。在相同时间内表示该反应速率最快的是