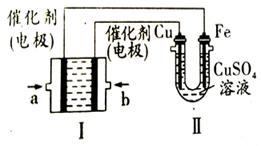
题目内容
[双选题]700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
 CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
BC
A项,反应在t1 min内以H2表示的平均速率应该是t1 min内H2的浓度变化量与t1的比值,而不是H2的物质的量变化量与t1的比值。B项,因为反应前后气体的物质的量保持不变,保持其他条件不变,平衡常数不会改变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,与起始时向容器中充入0.60 mol H2O和1.20 mol CO的效果是一致的,达到平衡时,n(CO2)=0.40 mol。C项,保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,平衡向右移动,达到新平衡时CO的转化率增大,H2O的转化率减小,H2O的体积分数会增大。D项,原平衡常数计算(注意代入浓度)结果为1,温度升高至800℃,上述反应平衡常数为0.64,说明温度升高,平衡向左移动,那么正反应为放热反应。

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
 CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.
CH3OH(g)+H2O(g)+49kJ。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。a,b,c,d括号内数据表示坐标.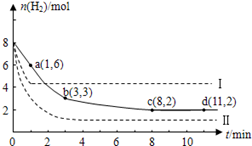
 2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。
2SO3(g) △H=-196 kJ?mol-1。在一个固定容积为5 L的密闭容器中充入0.20 mol SO2和0.10 mol O2,半分钟后达到平衡,测得容器中含SO3为0.18 mol,则v(O2)= mol?L-1?min-1,放出的热量为 kJ。 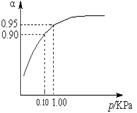
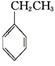 (g)+CO2(g)
(g)+CO2(g)
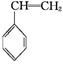 (g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
(g)+CO(g)+H2O(g)ΔH="-166" kJ·mol-1
 2NO2(g)
2NO2(g) 2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )
2NH3,某段时间内的平均反应速率分别用v(N2)、v(H2)、v(NH3)表示(单位均为mol·L-1·s-1)时,下列关系式中正确的是( )