��Ŀ����
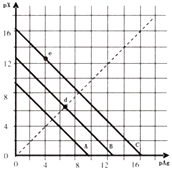
����Ŀ��ij��ɫ��Һ�к��еĽ���������ΪMg2����Al3���������Һ�л����ص���NaOH��Һֱ���������������������ʵ��������NaOH�����ʵ����Ĺ�ϵ��ͼ��ʾ��

(1)�ɴ�ȷ��ԭ��Һ��һ������������ij�����ӣ���������________��
(2)������ΪMgCl2��Al2(SO4)3����ԭ��Һ�������ӵ����ʵ���Ϊ______________��
(3)����ͼ���У��������ʾ�����Լ���ͨ����������ʵ������������ʾ������������������ͼ�����Ż����ֻش��������⣺

��.��ʾ��AlCl3��Һ���μ�NaOH��Һ����______��
��.��ʾ��NaAlO2��Һ���μ�ϡ�������________��
��.��ʾ��NaAlO2��Һ��ͨ��CO2����________��
��.��ͼ____________(��ܡ����ܡ�)������NaOH�ij���ʯ��ˮ��ͨ��CO2��
���𰸡� ������(H��) 0.1 mol �� �� �� ����
����������1������ͼ���֪��ʼ��û�г���������˵����Һ�л����������ӣ���2������ͼ���֪�������ٽ�����������������������Һ��Ӧ���ܽ�����������������0.5mol��0.4mol��0.1mol�����ݷ���ʽAl(OH)3��NaOH��NaAlO2��2H2O��֪����������0.1mol��������ԭ���غ��֪ԭ��Һ����������0.1mol����3����.��AlCl3��Һ���μ�NaOH��Һ�����ķ�Ӧ����ΪAl3����3OH��===Al(OH)3����Al(OH)3��OH��===AlO2����2H2O�����ͼ��ٷ�������.��NaAlO2��Һ���μ�ϡ���ᷢ���ķ�Ӧ����ΪAlO2����H����2H2O===Al(OH)3����Al(OH)3��3H��===Al3����3H2O��ͼ��ݷ�������.��NaAlO2��Һ��ͨ��CO2������������������CO2������������ܽ⣬ͼ���������.��NaOH�ij���ʯ��ˮ��ͨ��CO2����������̼��Ƴ���������ͼ��۲�������