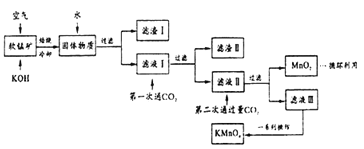
题目内容
【题目】水的电离平衡曲线如图所示: 
(1)若以A点表示25℃时水电离平衡时离子的浓度,当温度升高到100℃时,水的电离平衡状态变到B点(横纵坐标都是10﹣6 , )则此时水的离子积从变到 , 造成水的离子积变化的原因是 .
(2)已知25℃时,0.1L 0.1molL﹣1的NaA溶液的pH=10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为
(3)25℃时,将pH=11的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=9,则NaOH溶液与硫酸溶液的体积比为 .
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是
(5)常温25℃时pH=2的硫酸升高到100℃时pH=常温25℃时pH=12NaOH升高到100℃时pH= .
【答案】
(1)10﹣14;10﹣12;水的电离为吸热反应,升高温度促进水电离
(2)c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
(3)1:9
(4)a+b=13
(5)2;10
【解析】解:(1)水的离子积KW=c(H+)c(OH﹣),25℃时,KW=c(H+)c(OH﹣)=10﹣7×10﹣7=10﹣14 , 100℃时,KW=c(H+)c(OH﹣)=10﹣6×10﹣6=10﹣12 , 水的电离为吸热反应,升高温度促进水电离,导致水的离子积常数增大, 所以答案是:10﹣14;10﹣12;水的电离为吸热反应,升高温度促进水电离;(2)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,HA属于弱电解质,NaA溶液中所存在的离子的物质的量浓度由大到小的顺序c(Na+)>c(A﹣)>c(OH﹣)>c(H+)
所以答案是:c(Na+)>c(A﹣)>c(OH﹣)>c(H+);(3)设氢氧化钠溶液的体积为xL,硫酸溶液的体积为yL,pH=11的NaOH溶液中,氢氧根离子的浓度为:10﹣3mol/L,pH=4的硫酸溶液中氢离子浓度为:10﹣4mol/L,二者混合后溶液的pH=9,溶液酸性碱性,溶液中氢氧根离子的浓度为10﹣5mol/L,即氢氧化钠过量,
即10﹣3mol/L×xL﹣10﹣4mol/L×y=10﹣5mol/L(x+y),
解得x:y=1:9,
所以答案是:1:9;(4)设强酸溶液的pH为a,体积为10V,溶液中氢离子浓度为:10﹣amol/L;碱溶液的pH为b,体积为V,溶液中氢氧根离子的浓度为:10﹣(12﹣b)mol/L,混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10﹣amol/L×10VL=10﹣(12﹣b)mol/L×VL,
解得:1﹣a=b﹣12,a+b=13,
所以答案是:a+b=13;(5)常温25℃时pH=2的硫酸升高到100℃时,离子积常数增大,但溶液中硫酸电离出的氢离子浓度不变PH=2,常温25℃时pH=12NaOH升高到100℃时氢氧根离子浓度不变c(OH﹣)= ![]() =10﹣2mol/L,但离子积常数变化为Kw=10﹣12 , c(H+)=
=10﹣2mol/L,但离子积常数变化为Kw=10﹣12 , c(H+)= ![]() =10﹣10mol/L,溶液PH=10,
=10﹣10mol/L,溶液PH=10,
所以答案是:2;10.

 导学教程高中新课标系列答案
导学教程高中新课标系列答案