题目内容
【题目】请阅读下列材料,回答下列小题。
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
【1】铁生锈总反应属于 ( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【2】关于反应4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3,下列说法正确的是 ( )
4Fe(OH)3,下列说法正确的是 ( )
A.O2发生还原反应
B.Fe(OH)2被还原
C.H2O发生氧化反应
D.H2O是氧化剂
【3】下列反应条件的改变对4Fe+3O2+xH2O![]() 2Fe2O3·xH2O速率的影响不正确的是( )
2Fe2O3·xH2O速率的影响不正确的是( )
A.增大O2的浓度能加快生锈速率
B.潮湿环境中铁生锈的速率更快
C.升高温度能加快生锈速率
D.干燥空气中铁生锈速率更快
【4】下列反应吸收热量的是 ( )
A.铁与稀盐酸反应
B.铁丝在氧气中燃烧
C.铝还原氧化铁
D.碳与二氧化碳反应
【答案】
【1】A
【2】A
【3】D
【4】D
【解析】
1. 铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O,反应中三种物质反应生成一种物质,属于化合反应;
2Fe2O3·xH2O,反应中三种物质反应生成一种物质,属于化合反应;
2. 反应中铁元素从+2价升高到+3价,失去电子,被氧化,氧元素从0价降低到-2价,得到电子,被还原,反应中Fe(OH)2作还原剂,O2为氧化剂;
3. 升高温度,增大浓度都能使反应速率加快;
4. 金属与酸的反应、燃烧反应、酸碱中和反应、铝热反应均为放热反应。
【1】铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O,反应中三种物质反应生成一种物质,属于化合反应;
2Fe2O3·xH2O,反应中三种物质反应生成一种物质,属于化合反应;
【2】由分析可知,Fe(OH)2作还原剂,被氧化,O2为氧化剂,被还原,正确的选A;
【3】A. 增大O2的浓度能加快生锈速率,A项正确,不符合题意;
B. 潮湿环境中铁生锈的速率更快,B项正确,不符合题意;
C. 升高温度能加快生锈速率,C项正确,不符合题意;
D. 干燥空气中铁不易生锈,D项错误,符合题意;
答案选D。
【4】A. 铁与稀盐酸的反应为放热反应,A项正确,不符合题意;
B. 铁丝在氧气中燃烧的反应为放热反应,B项正确,不符合题意;
C. 铝还原氧化铁的反应为放热反应,C项正确,不符合题意;
D. 碳与二氧化碳反应的反应为吸热反应,D项错误,符合题意;
答案选D。

【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:(图中涉及物质为气态)

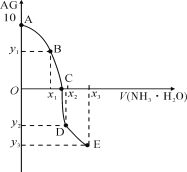
(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式______。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
2NH3(g)△H<0,其化学平衡常数K与温度t的关系如下表,
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1______K2(填写“>”、“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)。
a .容器内N2,H2,NH3的浓度之比为1:3:2 b. υ(N2)正=3υ(H2)逆
c .容器内压强保持不变 d. 混合气体的密度保持不变
③在400℃时,当测得NH3和N2,H2的物质的量分别为1mol和2mol,3mol时,则该反应的υ(N2)正______υ(N2)逆(填写“>,“=”或“<”)。
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
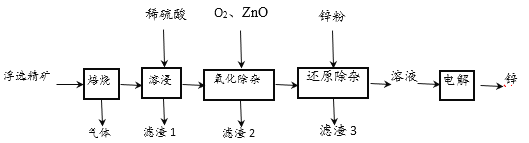
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c (Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | x | 8.3 | 8.2 | 9.4 |
常温下,Ksp[Fe(OH)3]=1×10-38,溶液中当离子浓度小于1×10-5mol/L时可认为沉淀完全。回答下列问题:
(1)用稀硫酸溶浸时,产生PbSO4和SiO2沉淀,经过滤后,向滤液中加入O2、ZnO,目的是除去杂质Fe2+、Fe3+,则氧化除杂工序中ZnO的作用是调节溶液的pH,应调节溶液的pH的范围为_______(填数值)。
(2)用铂电极电解硫酸锌溶液制备单质锌时,电解的总反应为________,电解使锌沉积后,电解液可返回_______工序循环使用。