题目内容
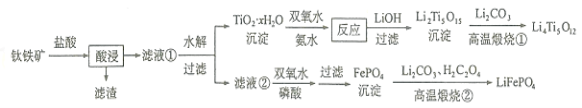
【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
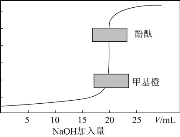
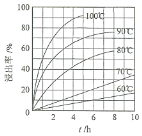
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。
(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为![]() ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。
【答案】100℃、2h或90℃、5h FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O 40℃时TiO2xH2O转化率最高,因低于40℃,TiO2xH2O转化反应速率随温度升高而增加,超过40℃,双氧水分解与氨气逸出导致TiO2xH2O转化反应速率下降 4 2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
【解析】
用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备Li4Ti5O12和LiFePO4,由制备流程可知,加盐酸过滤后的滤渣为SiO2,滤液①中含Mg2+、Fe2+、Ti4+,水解后过滤,沉淀为TiO2·xH2O,与双氧水反应Ti元素的化合价升高,生成(NH4)2Ti5O15,与LiOH反应后过滤得到Li2Ti5O15,再与碳酸锂高温反应生成Li4Ti5O12;水解后的滤液②中含Mg2+、Fe2+,双氧水可氧化亚铁离子,在磷酸条件下过滤分离出FePO4,高温煅烧②中发生2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑,以此来解答。
2LiFePO4+H2O+3CO2↑,以此来解答。
(1)由图可知,当铁的浸出率为70%时,所采用的实验条件为选择温度为100℃、2h或90℃、5h;
(2)“酸浸”后,钛主要以TiOCl42-形式存在,相应反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O;
(3)40℃时TiO2xH2O转化率最高,因低于40℃,TiO2xH2O转化反应速率随温度升高而增加,超过40℃,双氧水分解与氨气逸出导致TiO2xH2O转化反应速率下降;
(4)Li2Ti5O15中Ti的化合价为+4,Li的化合价为+1价,由化合价的代数和为0可知,O元素的负价代数和为22,设过氧键的数目为x,则(x×2)×1+(15-x×2)×2=22,解得x=4,即Li2Ti5O15中过氧键的数目为4;
(5)“高温煅烧②”中由FePO4制备LiFePO4的化学方程式为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O+3CO2↑。
2LiFePO4+H2O+3CO2↑。

 计算高手系列答案
计算高手系列答案【题目】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)![]() CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应温度T/K | 500 | 500 | 600 |
反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
平衡常数K | K1 | K2 | K3 |
下列叙述正确的是( )
A. v1<v2,2c1>c2B. α1(CO)>α3(CO),v1<v3
C. p2>2p3,K1<K3D. c2>2c3,α2(CH3OH)+α3(CO)<1