题目内容
2.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
分析 由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)电子层结构相同,核电荷数越大离子半径越小;⑩元素在周期表的位置为第四周期ⅦA族;稀有气体化学性质最不活泼;非金属性越强,氢化物越稳定;
(2)上述元素中Cl的最高价含氧酸高氯酸酸性最强,K的金属性最强,故氢氧化钾的碱性最强;
(3)同主族自上而下,非金属性减弱,最高价氧化物对应水化物的酸性减弱;可以利用强酸制备弱酸原理进行验证;
(4)实验室用氯化铵与氢氧化钙反应制备氨气,反应生成氯化钙、氨气与水;碳与浓硝酸反应生成二氧化碳、二氧化氮与水;
(5)钠与水反应生成氢氧化钠与氢气.
解答 解:由元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br.
(1)电子层结构相同,核电荷数越大离子半径越小,故离子半径Cl-<S2-;⑩元素在周期表的位置为第四周期ⅦA族;稀有气体Ar最外层为稳定结构,化学性质最不活泼;同主族自上而下非金属性减弱,非金属性越强,氢化物越稳定,故氢化物稳定性H2O>H2S,
故答案为:<;第四周期ⅦA族;Ar;H2O;
(2)上述元素中Cl的最高价含氧酸高氯酸酸性最强,高氯酸化学式为HClO4,K的金属性最强,故KOH碱性最强,故答案为:HClO4;KOH;
(3)同主族自上而下,非金属性减弱,最高价氧化物对应水化物的酸性减弱,故酸性H2CO3>H2SiO3;可以利用强酸制备弱酸原理进行验证,方程式为:Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
故答案为:H2CO3;Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3;
(4)实验室用氯化铵与氢氧化钙反应制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;碳与浓硝酸反应生成二氧化碳、二氧化氮与水,反应方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;NH4NO3;C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O;
(5)钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故答案为:2Na+2H2O=2Na++2OH-+H2↑.
点评 本题考查元素周期表与元素周期律综合应用,侧重对基础知识的巩固,注意熟练掌握周期表的结构,难度不大.

| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
| A. | 硫酸铝与氨水反应:Al3++3 OH-═Al(OH)3↓ | |
| B. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| C. | 饱和NH4Cl溶液中加入NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| D. | 氯气通入FeCl2溶液中:2Fe2++Cl2═2 Fe3++2Cl- |
①3000℃Si(s)+3HCl(g)=SiHCl3(g)+H2(g) (放热反应)
②950℃SiHCl3(g)+H2 (g)=Si(s)+3HCl(g)
对上述两个反应的下列叙述中,错误的是( )
| A. | 两个反应都是氧化还原反应 | |
| B. | 两个反应都是置换反应 | |
| C. | 两个反应都有化学能与热能之间的转化 | |
| D. | 反应(2)是放热反应 |
(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
| 序号 | $\frac{m}{n}$ | 固体成分 | 排出气体物质成分 |
| ① | <$\frac{1}{2}$ | Na2CO3 | |
| ② | =$\frac{1}{2}$ | Na2CO3 | O2、H2O |
| ③ | $\frac{1}{2}$<$\frac{m}{n}$<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
| A. | CO2的比例模型: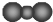 | B. | N原子最外层轨道表示式: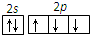 | ||
| C. | Cl原子的结构示意图: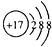 | D. | Al原子最外层电子排布式:3s23p1 |
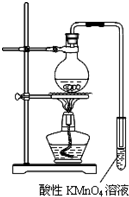 某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $\stackrel{醇△}{→}$CH2=CH2↑+NaBr+H2O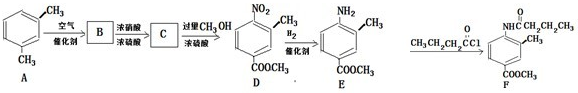
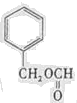
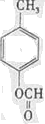
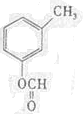
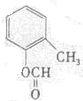 (写结构简式).
(写结构简式).