题目内容
7.(1)任何一个自发的氧化还原反应都可以设计成一个原电池.请根据:Fe+2FeCl3═3FeCl2 设计成一个原电池.该电池的负极材料为Fe,其电极反应为Fe-2e-=Fe2+;正极材料为不如铁活泼的金属或石墨,其电极反应为2Fe3++2e-=2Fe2+.
(2)①氢氧燃料电池,电解质溶液为稀H2SO4时:正极:O2+4e-+4H+=2H2O
②氢氧燃料电池,电解质溶液为KOH溶液时:负极:2H2-4e-+4OH-=4H2O总反应方程式:2H2+O2=2H2O.
分析 (1)原电池中,失电子化合价升高的金属作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质为原电池电解质;
(2)①氢氧燃料酸性电池中,正极上氧气得电子和氢离子反应生成水;
②氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水;
总反应方程式和氢气燃烧方程式相似.
解答 解:(1)原电池中,失电子化合价升高的金属作负极、不如负极活泼的金属或导电的非金属作正极,得电子化合价降低的电解质为原电池电解质,该原电池中,Fe元素化合价由0价、+3价变为+2价,所以Fe是负极、不如铁活泼的金属或导电的非金属作正极,如铜、石墨等,负极上铁失电子发生氧化反应,电极反应式为Fe-2e-=Fe2+,正极上铁离子得电子发生还原反应,电极反应式为,
故答案为:Fe;Fe-2e-=Fe2+;不如铁活泼的金属或石墨;2Fe3++2e-=2Fe2+;
(2)①氢氧燃料酸性电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O,故答案为:O2+4e-+4H+=2H2O;
②氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,负极反应式为2H2-4e-+4OH-=4H2O,总反应方程式和氢气燃烧方程式相似,则电池反应式分别为2H2+O2=2H2O,
故答案为:2H2-4e-+4OH-=4H2O;2H2+O2=2H2O.
点评 本题考查原电池设计,侧重考查正负极的判断及电极反应式的书写,会根据原电池反应式元素化合价变化确定正负极材料,注意电极反应式的书写与电解质溶液酸碱性有关,题目难度中等.

练习册系列答案
相关题目
17.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物( )
| A. | Be(OH )2 | B. | Al(OH)3 | C. | NaOH | D. | RbOH |
18.下列除杂方法错误的是( )
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
2.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
(1)⑦元素的离子半径<S2-(填“>”或“<”)写出⑩元素在周期表的位置第四周期ⅦA族;在这些元素中,化学性质最不活泼的是:Ar.(填元素符号)比较③与⑥的氢化物,H2O更稳定(填化学式)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
12.下列各组顺序的排列不正确的是( )
| A. | 原子半径:Na<Mg<Al | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<HNO3 | D. | 碱性强弱:KOH>NaOH>LiOH |
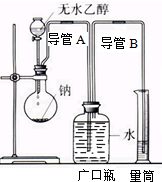 为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:
为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题: