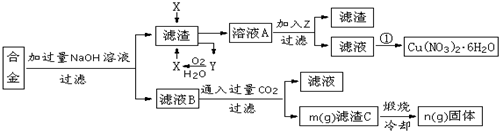
题目内容
13.下列离子方程式书写错误的是( )| A. | 硫酸铝与氨水反应:Al3++3 OH-═Al(OH)3↓ | |
| B. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| C. | 饱和NH4Cl溶液中加入NaOH浓溶液:NH4++OH-═NH3↑+H2O | |
| D. | 氯气通入FeCl2溶液中:2Fe2++Cl2═2 Fe3++2Cl- |
分析 A.反应生成氢氧化铝和硫酸铵;
B.反应生成硅酸和碳酸钠;
C.反应生成氯化钠、氨气和水;
D.反应生成氯化铁,遵循电子、电荷守恒.
解答 解:A.硫酸铝与氨水反应的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故A错误;
B.硅酸钠溶液中通入CO2气体的离子反应为SiO32-+H2O+CO2═H2SiO3↓+CO32-,故B正确;
C.饱和NH4Cl溶液中加入NaOH浓溶液的离子反应为NH4++OH-═NH3↑+H2O,故C正确;
D.氯气通入FeCl2溶液中的离子反应为2Fe2++Cl2═2Fe3++2Cl-,故D正确;
故选A.
点评 本题考查离子反应书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、与量有关的离子反应考查,注意氢氧化铝不溶于弱碱,题目难度不大.

练习册系列答案
相关题目
4.短周期元素中具有相同电子层结构的三种微粒An+、Bn-、C 下列分析正确的是( )
| A. | 原子序数关系:C>B>A | B. | 微粒半径关系:Bn->C>An+ | ||
| C. | C微粒是稀有气体元素的原子. | D. | 原子半径关系是:B>A>C |
1.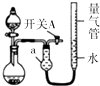 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)仪器a的名称是干燥管.
(2)检查该装置的气密性的方法是:关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高,说明气密性良好.
(3)该同学认为实验①可通过收集测量NO2气体的体积,来探究Cu样品的纯度.请问是否可行否(填“是”或“否”);实验①中烧瓶内反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)实验②中,量气管中的液体最好是D:
A.H2O B.饱和NaHCO3溶液C.饱和Na2CO3溶液 D.CCl4
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②保持量气管内液体与干燥管内液体液面相平,③视线与凹液面最低处相平.
(6)实验③获得以下数据(所有气体体积均已换算成标准状况).
根据上述合理数据计算粗Mg中Mg的质量分数72%.
 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、浓HNO3 | H2O | |
| ② | CaO固体、浓氨水 | NH3 | |
| ③ | 粗镁、稀H2SO4 (足量)[杂质不与硫酸反应] | H2 | H2O |
(2)检查该装置的气密性的方法是:关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高,说明气密性良好.
(3)该同学认为实验①可通过收集测量NO2气体的体积,来探究Cu样品的纯度.请问是否可行否(填“是”或“否”);实验①中烧瓶内反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)实验②中,量气管中的液体最好是D:
A.H2O B.饱和NaHCO3溶液C.饱和Na2CO3溶液 D.CCl4
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②保持量气管内液体与干燥管内液体液面相平,③视线与凹液面最低处相平.
(6)实验③获得以下数据(所有气体体积均已换算成标准状况).
| 编号 | 镁(含杂质)质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 0.5g | 10.0mL | 346.5mL |
| 2 | 0.5g | 10.0mL | 335.0mL |
| 3 | 0.5g | 10.0mL | 345.5mL |
8.下列叙述不正确的是( )
| A. | 氮的氧化物可引起光化学烟雾 | |
| B. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| C. | SO2可以用作食物和干果的防腐剂 | |
| D. | 铵盐受热易分解,生成氨气和对应的酸 |
18.下列除杂方法错误的是( )
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
5.有序排列是学习化学的重要方法,下列排序不正确的是( )
| A. | 还原性强弱:F-<Cl-<I- | B. | 半径K+>Mg2+>Al3+>H+ | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
2.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
(1)⑦元素的离子半径<S2-(填“>”或“<”)写出⑩元素在周期表的位置第四周期ⅦA族;在这些元素中,化学性质最不活泼的是:Ar.(填元素符号)比较③与⑥的氢化物,H2O更稳定(填化学式)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.