题目内容
12.有两种主族元素X和Y,X元素的单质通常是黄色固体,X原子M电子层上的电子数为Y原子M电子层上的电子数的3倍,则X、Y的元素符号分别为( )| A. | Si和B | B. | N和Be | C. | S和Mg | D. | C和Al |
分析 两种主族元素X和Y,X元素的单质通常是黄色固体,则X为S元素;S原子M电子层上的电子数为6,它的M层电子数是Y原子M电子层上的电子数的3倍,则Y原子的M电子层的电子数为2,所以Y核外有12个电子,据此判断X、Y元素.
解答 解:两种主族元素X和Y,X元素的单质通常是黄色固体,则X为S元素;S原子M电子层上的电子数为6,它的M层电子数是Y原子M电子层上的电子数的3倍,则Y原子的M电子层的电子数为2,所以Y的电子排布为2、8、2,即Y核外有12个电子,则为Mg元素,故C正确;
故选C.
点评 本题考查了元素的推断,主要考查根据核外电子排布规律推断元素,难度不大,理解核外电子排布规律并能灵活运用.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
2.下列有关说法错误的是( )
| A. | 石油和天然气的主要成分都是碳氢化合物 | |
| B. | 甲烷和乙烯都能与Cl2发生反应 | |
| C. | 乙烯可以合成有机高分子材料 | |
| D. | 苯和乙醇都能被酸性KMnO4溶液氧化而使KMnO4溶液褪色 |
20.下列条件下的反应,放出氢气最快的是( )
| 金属(相同粉末状) 和物质的量(mol) | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Fe | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Cu | 0.1 | 4mol/L H2SO4 | 10 | 20℃ |
| D | Mg | 0.1 | 稀6mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
17.碱性强弱介于KOH和Mg(OH)2之间的氢氧化物( )
| A. | Be(OH )2 | B. | Al(OH)3 | C. | NaOH | D. | RbOH |
4.短周期元素中具有相同电子层结构的三种微粒An+、Bn-、C 下列分析正确的是( )
| A. | 原子序数关系:C>B>A | B. | 微粒半径关系:Bn->C>An+ | ||
| C. | C微粒是稀有气体元素的原子. | D. | 原子半径关系是:B>A>C |
1.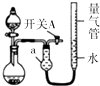 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
(1)仪器a的名称是干燥管.
(2)检查该装置的气密性的方法是:关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高,说明气密性良好.
(3)该同学认为实验①可通过收集测量NO2气体的体积,来探究Cu样品的纯度.请问是否可行否(填“是”或“否”);实验①中烧瓶内反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)实验②中,量气管中的液体最好是D:
A.H2O B.饱和NaHCO3溶液C.饱和Na2CO3溶液 D.CCl4
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②保持量气管内液体与干燥管内液体液面相平,③视线与凹液面最低处相平.
(6)实验③获得以下数据(所有气体体积均已换算成标准状况).
根据上述合理数据计算粗Mg中Mg的质量分数72%.
 某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
某同学设计图所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| ① | Cu、浓HNO3 | H2O | |
| ② | CaO固体、浓氨水 | NH3 | |
| ③ | 粗镁、稀H2SO4 (足量)[杂质不与硫酸反应] | H2 | H2O |
(2)检查该装置的气密性的方法是:关闭开关A和分液漏斗活塞,微热烧瓶,量气管右端液面升高,说明气密性良好.
(3)该同学认为实验①可通过收集测量NO2气体的体积,来探究Cu样品的纯度.请问是否可行否(填“是”或“否”);实验①中烧瓶内反应的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(4)实验②中,量气管中的液体最好是D:
A.H2O B.饱和NaHCO3溶液C.饱和Na2CO3溶液 D.CCl4
(5)本实验应对量气管多次读数,读数时应注意:
①恢复至室温,②保持量气管内液体与干燥管内液体液面相平,③视线与凹液面最低处相平.
(6)实验③获得以下数据(所有气体体积均已换算成标准状况).
| 编号 | 镁(含杂质)质量 | 量气管第一次读数 | 量气管第二次读数 |
| 1 | 0.5g | 10.0mL | 346.5mL |
| 2 | 0.5g | 10.0mL | 335.0mL |
| 3 | 0.5g | 10.0mL | 345.5mL |
2.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
(1)⑦元素的离子半径<S2-(填“>”或“<”)写出⑩元素在周期表的位置第四周期ⅦA族;在这些元素中,化学性质最不活泼的是:Ar.(填元素符号)比较③与⑥的氢化物,H2O更稳定(填化学式)
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
