题目内容
14.将m mol Na2O2和n mol NaHCO3固体混合物在密闭容器中加热到250℃,让其充分反应后排出气体.(1)分析m和n按不同比值进行反应时,容器内固体成分与排出气体成分的5种情况填写在下表中(设只有当CO2与Na2O2反应完后,H2O才与Na2O2反应).
| 序号 | $\frac{m}{n}$ | 固体成分 | 排出气体物质成分 |
| ① | <$\frac{1}{2}$ | Na2CO3 | |
| ② | =$\frac{1}{2}$ | Na2CO3 | O2、H2O |
| ③ | $\frac{1}{2}$<$\frac{m}{n}$<1 | ||
| ④ | =1 | ||
| ⑤ | >1 | Na2CO3、NaOH、Na2O2 |
分析 (1)将Na2O2和NaHCO3固体混合物在密闭容器中加热到250℃,发生反应的原理是:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O↑+CO2↑(i),
2Na2O2+2CO2=2Na2CO3+O2(ii),
2Na2O2+2H2O=4NaOH+O2(iii)据此讨论即可;
(2)根据消耗NaOH的总体积,结合在D点氢氧化钠与硝酸、铝铁离子的反应,可计算得出C点氢氧化钠溶液的体积.
解答 解:(1)①当$\frac{m}{n}$<$\frac{1}{2}$时,发生反应(i)和(ii),此时生成二氧化碳气体不能全部被吸收,所以排出气体为O2、H2O和CO2,故答案为:O2、H2O和CO2;
②当$\frac{m}{n}$=$\frac{1}{2}$时,也只发生反应(i)和(ii),此时过氧化钠恰好与碳酸氢钠分解生成的二氧化碳全部反应,故剩余气体为氧气和水蒸气,故答案为:O2、H2O;
③当$\frac{1}{2}<\frac{m}{n}<1$时,发生反应(i)(ii)(iii),此时水部分反应,故固体物质为:Na2CO3,NaOH,气体成分为:O2,H2O,故答案为:Na2CO3,NaOH;O2,H2O;
④当$\frac{m}{n}$=1时,发生反应(i)(ii)(iii),此时水液恰好全部反应,故固体物质为:Na2CO3,NaOH,气体成分为:O2,故答案为:Na2CO3,NaOH;O2;
⑤当$\frac{m}{n}$>1时,发生的化学反应为2NaHCO3+2Na2O2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+2NaOH+O2,过氧化钠有剩余,碳酸氢钠分解生成的二氧化碳和水完全反应,固体中含有Na2CO3、NaOH、Na2O2,排出气体为O2,故答案为:O2;
(2)2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2 ①
2 1 1
n $\frac{1}{2}$n $\frac{1}{2}$n
2Na2O2+2CO2=2Na2CO3+O2 ②
2 2 1
$\frac{1}{2}$n $\frac{1}{2}$n $\frac{1}{4}$n
2Na2O2+2H2O=4NaOH+O2 ③
2 2 1
x x $\frac{1}{2}$x,排出的水为$\frac{1}{2}$n-x,氧气的量为 $\frac{1}{4}$n+$\frac{1}{2}$x,当排出的O2和H2O为等物质的量时,则 $\frac{1}{2}$n-x=$\frac{n}{4}$+$\frac{1}{2}$x,x=$\frac{n}{6}$,所以m=$\frac{n}{2}$+x=$\frac{2}{3}$n,
故答案为:2:3.
点评 本题主要考查的是混合物的计算,涉及碳酸氢钠的分解、过氧化钠的性质等,难度较大,抓住题给信息“过氧化钠先与二氧化碳反应”是关键.

 名校课堂系列答案
名校课堂系列答案| A. | 原子序数关系:C>B>A | B. | 微粒半径关系:Bn->C>An+ | ||
| C. | C微粒是稀有气体元素的原子. | D. | 原子半径关系是:B>A>C |
| A. | 还原性强弱:F-<Cl-<I- | B. | 半径K+>Mg2+>Al3+>H+ | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 碱性:NaOH>Mg(OH)2>Al(OH)3 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的化学式是:KOH.
(3)比较①与⑤的最高价氧化物对应的水化物,H2CO3的酸性强(填化学式);用相应的化学方程式证明Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3.
(4)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;②的最高价氧化物的水化物浓溶液与①的单质反应的化学方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NO2↑+2H2O(用化学方程式表示)
(5)写出④的单质与水反应的离子方程式2Na+2H2O=2Na++2OH-+H2↑.
C(s)+H2O(g)?CO(g)+H2(g);
CO(g)+H2O(g)?CO2(g)+H2(g).
当反应达到平衡时,c(H2)=1.9mol•L-1,c(CO)=0.1mol•L-1.则下列叙述正确的是( )
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
 c.
c.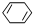 d.
d.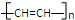
 +
+ $\stackrel{一定条件}{→}$
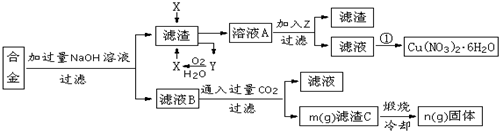
$\stackrel{一定条件}{→}$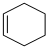 则要制备
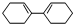
则要制备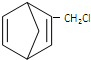 ,含共轭结构的原料可以是
,含共轭结构的原料可以是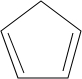 或
或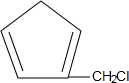 .(写结构简式)
.(写结构简式)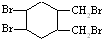 的合成路线(其他无机试剂任选).
的合成路线(其他无机试剂任选).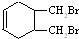 $\stackrel{Br_{2}}{→}$
$\stackrel{Br_{2}}{→}$