题目内容
7.在下列条件下,能大量共存的微粒组是( )| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
分析 A.c(H+)=1×10-14mol/L的溶液中存在大量氢氧根离子,四种离子之间不发生反应,都不与氢氧根离子反应;
B.铝离子与碳酸氢根离子、次氯酸根离子、碳酸根离子发生双水解反应;
C.与铝反应生成氢气的溶液为酸性或碱性溶液,铵根离子、钙离子与氢氧根离子反应,酸性条件下硝酸根离子能够氧化碘离子;
D.碳酸根离子、偏铝酸根离子水解,溶液显示碱性,不可能为中性.
解答 解:A.c(H+)=1×10-14mol/L的溶液为碱性溶液,溶液中存在大量氢氧根离子,K+、Na+、AlO2-、S2O32-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.Al3+、HCO3-、ClO-、CO32-之间发生双水解反应,在溶液中不能大量共存,故B错误;
C.能与Al反应生成H2的溶液中存在大量氢离子或氢氧根离子,NH4+、Ca2+与氢氧根离子反应,酸性条件下NO3-、I-离子之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.CO32-、AlO2-发生水解反应,溶液显示碱性,不可能为中性溶液,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存.

练习册系列答案
相关题目
3.在下列自然资源的开发利用中,不涉及化学变化的是( )
| A. | 用海水制盐 | B. | 从海水中提取镁 | C. | 从海水中提取溴 | D. | 从海带中提取碘 |
4.一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )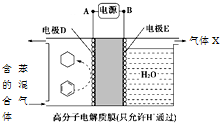

| A. | A为电源的正极 | |
| B. | 气体X是H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
15.下列说法正确的是( )
| A. | 燃烧一定要用火去点燃 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
12.化学与社会、生活密切相关.下列现象或事实的解释正解的是( )
| 选项 | 现象或事实 | 解释 |
| A | 常温下将Al片放入浓硝酸中无明显变化 | Al与浓硝酸不反应 |
| B | 加热滴有酚酞的醋酸钠溶液,溶液红色变深 | 加热促进CH3COO-水解,溶液的碱性增强 |
| C | 将溴水分别滴入植物油和裂化汽油中,溴水均褪色 | 前者由于萃取而褪色,后者由于发生加成反应而褪色 |
| D | 加热NaHCO3溶液无明显变化 | NaHCO3的热稳定性强 |
| A. | A | B. | B | C. | C | D. | D |
19.若NA表示阿伏伽德罗常数,下列说法正确的是( )
| A. | 通常状况下14gN2中含有电子的数目为7NA | |
| B. | 标准状况下,22.4L水中含有水分子的数目为NA | |
| C. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
16.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴乙烷制乙烯;由石油制乙烯 | |
| B. | 由乙烯制乙烷;由乙醇制乙醛 | |
| C. | 乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 | |
| D. | 由硝酸与苯反应制硝基苯;甲烷与Cl2光照 |
 .
.