题目内容
14. 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2$\frac{\underline{\;高温\;}}{\;}$6SO2+Fe3O4,3 mol FeS2参加反应转移32mol 电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.从腐蚀废液回收得到金属铜还需要的试剂为铁粉、稀盐酸.
(3)与明矾相似,硫酸铁也可用于净水,其原理是Fe3++3H2O?Fe(OH)3+3H+(用离子方程式表示);在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是酸性条件下抑制了三价铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉淀除去.
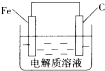
(4)钢铁的电化学腐蚀简单示意图如图,发生吸氧腐蚀时,正极的电极反应式为O2+4e-+2H2O═4OH-;该图稍作修改即可成为钢铁电化学防护的简单示意图,请完成防护的简单示意图并标出电子流动的方向.
(5)铁红是一种红色颜料,其成分是Fe2O3.将一定量的铁红溶于160mL5mol/L盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检验,溶于中无Fe3+,则参加反应的铁粉的质量为11.2g.
分析 (1)反应3FeS2+8O2=Fe3O4+6SO2中Fe元素化合价又+2→+3,化合价升高,S元素化合价由-1→+4,化合价升高,O元素化合价由0→-2,化合价降低,依据化合价变化计算转移电子数目;
(2)三价铁离子与铜发生氧化还原反应生成二价铁离子和铜离子;腐蚀废液含有铜离子、二价铁离子,加热过量铁粉将三价铁离子转化为二价铁离子,铜离子转化为铜,然后加入过量盐酸溶解过量的铁粉;
(3)三价铁离子水解生成氢氧化铁和氢离子,氢氧化铁胶体具有吸附性,能够净水;依据化学平衡移动影响因素判断解答;
(4)钢铁的吸氧腐蚀,正极氧气得到电子发生还原反应结合水生成氢氧根离子;要防止铁的腐蚀,可以将碳换成锌,形成原电池,采取牺牲阳极的阴极保护法,依据原电池工作原理判断电子流向;
(5)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量.
解答 解:(1)反应3FeS2+8O2=Fe3O4+6SO2,前后各元素化合价的变化情况如下:
Fe:+2→+3,化合价升高;S:-1→+4,化合价升高;O:0→-2,化合价降低,3molFeS2参加反应,转移电子的物质的量为32mol,
故答案为:32;
(2)三价铁离子与铜发生氧化还原反应生成二价铁离子和铜离子,2Fe3++Cu=2Fe2++Cu2+,腐蚀废液含有铜离子、二价铁离子,加热过量铁粉将三价铁离子转化为二价铁离子,铜离子转化为铜,然后加入过量盐酸溶解过量的铁粉;
故答案为:2Fe3++Cu=2Fe2++Cu2+;铁粉、盐酸;
(3)三价铁离子水解生成氢氧化铁和氢离子,离子方程式:Fe3++3H2O?Fe(OH)3+3H+;酸性废水中含有大量氢离子,酸性条件下抑制了三价铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉淀除去;
故答案为::Fe3++3H2O?Fe(OH)3+3H+;酸性条件下抑制了三价铁离子的水解,无法生成氢氧化铁胶体,不能使悬浮物沉淀除去;
(4)钢铁的吸氧腐蚀,正极氧气得到电子发生还原反应结合水生成氢氧根离子,电极反应式为:O2+4e-+2H2O═4OH-;要想防止铁的腐蚀可以采取,牺牲阳极的阴极保护,将碳棒换为锌棒,电子有负极流向正极: ;
;
故答案为:O2+4e-+2H2O═4OH-; ;
;
(5)氢气的物质的量为 $\frac{2.24L}{22.4L/mol}$=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为$\frac{1}{3}$×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g;
点评 本题考查了铁的性质及原电池工作原理及金属的腐蚀与防护,明确铁的化学性质、金属腐蚀的电化学防护法是解题关键,题目难度不大.


| A. | 图①装置可验证酸性:H2CO3>H2SiO3 | |
| B. | 图②装置可用于收集气体H2 CO2 Cl2 NH3 | |
| C. | 图③装置可用于分离CCl4萃取碘水后的有机层和水层 | |
| D. | 图④装置中接通开关后,Zn片腐蚀速率增大,Cu片有气体放出 |
| A. | 通常状况下14gN2中含有电子的数目为7NA | |
| B. | 标准状况下,22.4L水中含有水分子的数目为NA | |
| C. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
| A. | 该溶液中,K+、Ca2+、Cl2、Br-可以大量共存 | |
| B. | 与FeCl3反应的离子方程式:SO32-+2 Fe3++H2O═SO42-+2Fe2++2H+ | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |
| A. | 苯的同系物中碳原子数比苯分子中碳原子数多 | |
| B. | 苯环被KMnO4所氧化而破坏 | |
| C. | 侧链受苯环的影响而易被氧化 | |
| D. | 苯环和侧链相互影响,同时被氧化 |

 ;
;