题目内容
11.丙二醇是重要的化工原料,利用甘油制备二元醇符合绿色化学要求.
利用1,2-丙二醇可制得乳酸〔CH3CH(OH)COOH〕,乳酸与上述反应中的某一产物B可以反应,转换关系如下.已知A的碳原子数与乳酸相同,E、F为链状高分子化合物.请回答下列问题:
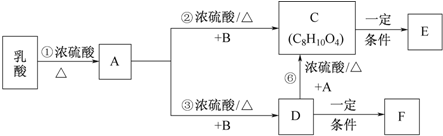
(1)反应①的反应类型是消去反应,A中所含官能团名称是碳碳双键、羧基.
(2)B在一定条件下反应生成分子式为C2H4O的有机物,该物质不能发生银镜反应,核磁共振氢谱中只有一个峰,写出该物质的结构简式
 .
.(3)F具有良好的光学性能和亲水性可作为隐形眼镜的材料,写出由D制备F的化学方程式
 .
.(4)写出1,2-丙二醇制备乳酸的合成路线
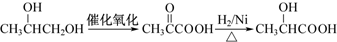 .
.(5)物质C (C8H10O4)存在含有苯环的同分异构体,已知:
①一个C原子上连两个羟基不稳定;
②苯环上含有4个取代基;
③分子中含有两个-CH2OH.符合上述条件的C的同分异构体有11种,写出其中一种的同分异构体的结构简式
 .
.
分析 乳酸与上述反应中的某一产物B可以反应,则B分子中含有羟基;A能够与B在浓硫酸作用下反应生成C、D,则A中一定含有羧基,故反应①为乳酸在浓硫酸作用下发生消去反应生成A为CH2═CHCOOH;结合A、C的分子组成可知,B一定含有两个羟基、两个C,则B为HO-CH2CH2-OH;C为CH2═CHCOOH与2分子乙二醇发生正反应生成的,则C的结构简式为:CH2═CHCOOCH2CH2OOCCH═CH2;A与1分子HO-CH2CH2-OH发生酯化反应生成D,则D为CH2=CHCOOCH2CH2OH;D发生加聚反应生成链状高分子化合物F,则F为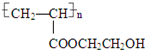 ;D分子中含有羟基,能够继续与C反应生成C,结合有机物的结构和性质解答该题.
;D分子中含有羟基,能够继续与C反应生成C,结合有机物的结构和性质解答该题.
解答 解:乳酸与上述反应中的某一产物B可以反应,则B分子中含有羟基;A能够与B在浓硫酸作用下反应生成C、D,则A中一定含有羧基,故反应①为乳酸在浓硫酸作用下发生消去反应生成A:CH2═CHCOOH;结合A、C的分子组成可知,B一定含有两个羟基、两个C,则B为HO-CH2CH2-OH;C为CH2═CHCOOH与2分子乙二醇发生正反应生成的,则C的结构简式为CH2═CHCOOCH2CH2OOCCH═CH2;A与1分子HO-CH2CH2-OH发生酯化反应生成D,则D为CH2=CHCOOCH2CH2OH;D发生加聚反应生成链状高分子化合物F,则F为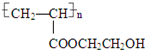 ;D分子中含有羟基,能够继续与C反应生成C,
;D分子中含有羟基,能够继续与C反应生成C,
(1)反应①为乳酸发生消去反应生成A:CH2═CHCOOH,A分子中含有的官能团为碳碳双键和羧基,故答案为:消去反应;碳碳双键、羧基;
(2)B为HO-CH2CH2-OH,B在一定条件下反应生成分子式为C2H4O的有机物,该物质不能发生银镜反应,核磁共振氢谱中只有一个峰,说明其分子中含有1个环状结构,该物质为乙二醇发生分之内脱水生成的,其结构简式为: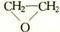 ,故答案为:
,故答案为: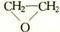 ;
;
(3)F为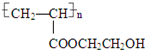 ,具有良好的光学性能和亲水性可作为隐形眼镜的材料,由D制备F的化学方程式为:
,具有良好的光学性能和亲水性可作为隐形眼镜的材料,由D制备F的化学方程式为: ,
,
故答案为: ;
;
(4)先将1,2-丙二醇催化氧化生成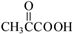 ,然后在催化剂存在条件下用氢气还原
,然后在催化剂存在条件下用氢气还原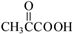 可以得到乳酸,该合成流程为:
可以得到乳酸,该合成流程为: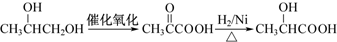 ,
,
故答案为: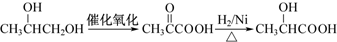 ;
;
(5)C的结构简式为CH2═CHCOOCH2CH2OOCCH═CH2,其分子中含有4个双键,所以其不饱和度为4;②苯环上含有4个取代基,苯环的不饱和度为4,说明其它结构为饱和结构;③分子中含有两个-CH2OH,①一个C原子上连两个羟基不稳定,则满足条件的有机物分子中含有1个苯环、2个酚羟基、2个-CH2OH;当两个酚羟基相邻时,将两个-CH2OH添加到苯环上,有4种添法,则有4种结构;当两个酚羟基在间位时,将两个-CH2OH添加到苯环上,有5种添法,则存在5种结构;当两个酚羟基在对位时,两个-CH2OH有2种添法,则存在2种同分异构体,所以总共存在的同分异构体的数目为4+5+2=11,如: ,
,
故答案为:11; .
.
点评 本题考查了有机合成,以丙二醇为载体,以信息和有机合成流程图的形式对有机化学进行了考查,题目难度较大,明确合成原理及常见有机物结构与性质为解答关键,试题侧重考查学生的阅读分析、迁移应用及创造能力,(5)为难点,需要明确书写规则:两个羟基分别在临位、间位、对位分别排列两个甲醇基.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 一定有甲烷 | B. | 一定有乙烷 | ||
| C. | 可能是甲烷和乙烷的混合物 | D. | 可能是乙烷和丙烷的混合物 |
| A. | 通常状况下14gN2中含有电子的数目为7NA | |
| B. | 标准状况下,22.4L水中含有水分子的数目为NA | |
| C. | 1molFe与足量稀盐酸反应时,转移电子的数目为3NA | |
| D. | 数目为NA的一氧化碳分子和0.5mol甲烷的质量比为7:4 |
| A. | 该溶液中,K+、Ca2+、Cl2、Br-可以大量共存 | |
| B. | 与FeCl3反应的离子方程式:SO32-+2 Fe3++H2O═SO42-+2Fe2++2H+ | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-═CaSO3↓+H2O | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |
| A. | 由溴乙烷制乙烯;由石油制乙烯 | |
| B. | 由乙烯制乙烷;由乙醇制乙醛 | |
| C. | 乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 | |
| D. | 由硝酸与苯反应制硝基苯;甲烷与Cl2光照 |
| A. | 醋酸溶液显酸性:CH3COOH?H++CH3COO- | |
| B. | 用氨水除去烟气中的SO2:SO2+2NH3•H2O=(NH4)2SO3+H2O | |
| C. | 向盐碱地中施放硫酸钙,降低其碱性:Na2CO3+CaSO4=CaCO3+Na2SO4 | |
| D. | 用三氯化铁溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+ |
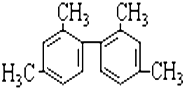
| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |