题目内容
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取Ni2O3.已知草酸的钙、镁、镍盐均难溶于水。工艺流程图如图所示:
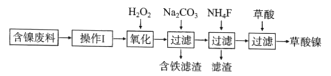
回答下列问题:
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以采取的措施为__________(写出两条)。
(2)加入H2O2发生的主要反应的离子方程式为________________
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是___________________
(4)将草酸镍(NiC2O4·2H2O)在热空气中干燥脱水,再采用高温煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为水蒸气和_________________
(5)工业上还可用电解法制取Ni2O3用NaOH溶液调 NiCl2,溶液的pH至7.5,加入适量Na 2SO4后利用惰性电极电解。电解过程中产生的Cl2,有80%在弱碱性条件下生成CIO-,再把二价镍氧化为三价镍。CIO-氧化Ni(OH)2生成Ni2O3的离子方程式为_______________________amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为_______mol.
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成原电池,放电时NiO(OH)转化为Ni(OH)2,则放电时负极的电极反应式为_______________
【答案】将含镍废料粉碎、适当增大稀硫酸的浓度、适当升温、搅拌等方法(任选2种) 2Fe2++ H2O2+2H+= 2Fe3++ 2H2O 促进Fe3+水解沉淀完全 CO、CO2 ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O 1.25a Al+4OH--3e-=AlO2-+2H2O
【解析】
将含镍废料(镍、铁、钙、镁合金为主)进行酸浸,转化为含有Ni2+、Fe2+、Ca2+、Mg2+的浸出液,向浸出液中加入双氧水,将Fe2+转化为Fe3+,再加入碳酸钠,调节溶液pH值,将Fe3+转化为氢氧化铁和碳酸钙沉淀过滤除去,再向滤液中加入NH4F,使Ca2+、Mg2+转化为CaF2、MgF2过滤除去,得到的滤液中加入草酸,将Ni2+转化为NiC2O4·2H2O,据此分析解答。
(1)“操作I”为“酸浸”,为了提高酸浸的效率,可以将含镍废料粉碎、适当增大稀硫酸的浓度、适当升温、搅拌等方法;
(2)加入H2O2,将Fe2+转化为Fe3+,离子方程式为:2Fe2++ H2O2+2H+= 2Fe3++ 2H2O;
(3)加入碳酸钠溶液调pH至4.0~5.0,其目的是促进Fe3+水解转化为氢氧化铁沉淀完全;
(4)草酸镍(NiC2O42H2O)在热空气中干燥脱水后生成NiC2O4,NiC2O4再发生氧化还原反应(Ni由+2价升高到+3价,则C由+3价降低到+2价,题中要求生成混合气体,则另一气体为CO2),再利用化合价升降相等,Ni:升高2×(3-2),C:升高1×(4-3),C:降低:3×(3-2),生成Ni2O3、CO、CO2,配平方程式为:2NiC2O4![]() Ni2O3+3CO↑+CO2↑,该混合气体的主要成分为水蒸气和CO、CO2 ;
Ni2O3+3CO↑+CO2↑,该混合气体的主要成分为水蒸气和CO、CO2 ;
(5)Cl由+1价降低到-1价,Ni由+2价升高到+3价,利用化合价升降相等可配平ClO-、Ni(OH)2、Cl-、Ni2O3的系数,再利用H原子守恒配平水的系数,最后可利用O原子检查配平是否正确,得到离子方程式为:ClO-+2Ni(OH)2═Cl-+Ni2O3+2H2O;
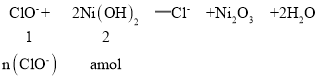
则n(ClO-)=0.5 a mol;
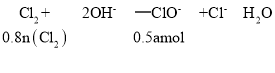
则n(Cl2)=0.625a mol;
进行电解时:
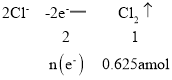
则n(e-)=1.25a mol;
(6)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,发生还原反应,则Al发生氧化反应,碱性条件下得到NaAlO2,该电池反应的化学方程式是:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2,则放电时负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】下列各组物质之间不可能实现如图所示转化的是( )
![]()
选项 | X | Y | Z | M |
A | S | SO2 | SO3 | O2 |
B | HNO3 | Fe(NO3)3 | Fe(NO3)2 | Fe |
C | NaOH | Na2CO3 | Na2CO3 | CO2 |
D | HN3 | NO | NO2 | O2 |
A. A B. B C. C D. D