题目内容
【题目】文物是人类宝贵的历史文化遗产,我国文物资源丰富,但保存完好的铁器比青铜器少得多,研究铁质文物的保护意义重大。

(1)铁刃铜钺中,铁质部分比铜质部分锈蚀严重,其主要原因是________。
(2)已知:
ⅰ.铁质文物在潮湿的土壤中主要发生吸氧腐蚀,表面生成疏松的FeOOH;
ⅱ.铁质文物在干燥的土壤中表面会生成致密的Fe2O3,过程如下。
![]()
①写出ⅰ中,O2参与反应的电极反应式和化学方程式:________、________。
②若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为________。
③结合已知信息分析,铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重的主要原因是________。
(3)(资料1)Cl–体积小穿透能力强,可将致密氧化膜转化成易溶解的氯化物而促进铁质文物继续锈蚀。
(资料2)Cl–、Br–、I–促进铁器皿继续锈蚀的能力逐渐减弱。
①写出铁质文物表面的致密氧化膜被氯化钠破坏的化学方程式________。
②结合元素周期律解释“资料2”的原因是________。
(4)从潮湿土壤出土或海底打捞的铁质文物必须进行脱氯处理:用稀NaOH溶液反复浸泡使Cl-渗出后,取最后一次浸泡液加入试剂 ________(填化学式)检验脱氯处理是否达标。
(5)经脱氯、干燥处理后的铁质文物再“覆盖”一层透明的高分子膜可以有效防止其在空气中锈蚀。下图为其中一种高分子膜的片段:
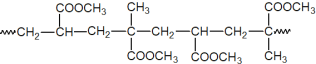
该高分子的单体是__________。
【答案】铁比铜活泼 O2+4e-+2H2O = 4OH- 4Fe(OH)2+O2 = 4FeOOH+2H2O 6:2:1 铁质文物在潮湿环境中表面生成疏松的FeOOH,水、氧气能通过孔隙使铁继续发生吸氧锈蚀;在干燥空气中形成致密的Fe2O3,隔绝了铁与水和氧气的接触,阻碍锈蚀 Fe2O3+6NaCl+3H2O = 6NaOH+2FeCl3 (Fe2O3 + H2O = 2FeOOH) 氯、溴、碘同主族,形成的阴离子随电子层数增加半径增大(或体积增大),穿透能力减弱 HNO3和AgNO3 ![]()
【解析】
铁比铜活泼,所以保存完好的铁器比青铜器少得多,金属一般发生吸氧腐蚀。
(1)因为铁比铜活泼,所以铁刃铜钺中,铁质部分比铜质部分锈蚀严重。
(2)①铁质文物在潮湿的土壤中主要发生吸氧腐蚀,O2在正极得电子发生还原反应,电极反应式为O2+4e-+2H2O = 4OH-,负极铁失电子发生氧化反应生成氢氧化亚铁,氧气与氢氧化亚铁反应生成疏松的FeOOH,化学方程式为4Fe(OH)2+O2 = 4FeOOH+2H2O。
②过程Ⅰ中铁由0价变为+2价,1molFe转移电子2mol,过程Ⅱ铁由+2价变为表征+![]() 价,1molFeO转移
价,1molFeO转移![]() mol电子,过程Ⅲ铁由表征+
mol电子,过程Ⅲ铁由表征+![]() 价变为+3价,1molFe3O4转移
价变为+3价,1molFe3O4转移![]() mol电子,若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为2:
mol电子,若ⅱ中每一步反应转化的铁元素质量相等,则三步反应中电子转移数之比为2:![]() :
:![]() = 6:2:1。
= 6:2:1。
③铁质文物在潮湿环境中表面生成疏松的FeOOH,水、氧气能通过孔隙使铁继续发生吸氧锈蚀;在干燥空气中形成致密的Fe2O3,隔绝了铁与水和氧气的接触,阻碍锈蚀,所以铁质文物在潮湿的土壤中比在干燥的土壤中锈蚀严重。
(3)①铁质文物表面的致密氧化膜为Fe2O3,根据题意Fe2O3与氯化钠反应生成氯化铁,根据元素守恒,反应物还应有水,生成物还应有氢氧化钠,化学方程式为Fe2O3+6NaCl+3H2O = 6NaOH+2FeCl3。
②氯、溴、碘同主族,形成的阴离子随电子层数增加半径增大(或体积增大),穿透能力减弱,导致Cl–、Br–、I–促进铁器皿继续锈蚀的能力逐渐减弱。
(4)用稀NaOH溶液反复浸泡对文物进行脱氯处理,脱氯过程中Cl-渗出后,要检验脱氯处理是否达标,只需检取最后一次浸泡液中是否含有Cl-即可,检验Cl-需要的试剂为HNO3和AgNO3。
(5)根据高分子膜的片段可知,该高分子的链节为 ,是由
,是由![]() 通过加聚反应生成的,故该高分子的单体是
通过加聚反应生成的,故该高分子的单体是![]() 。
。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
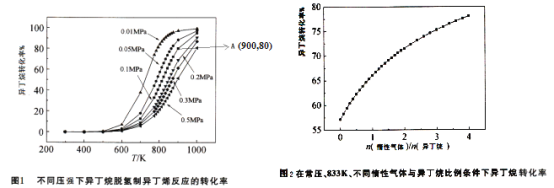
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。





