题目内容
9.茶是中国人民喜爱的饮品之一.为了定性检验茶叶中含有的Ca、A1、Fe三种元素,某化学兴趣小组的同学设计了如图流程所示的实验进行检验.他们查阅文献资料知道:①草酸铵[(NH4)2C2O4]属于弱电解质(即难电离).草酸钙(CaC2O4)难溶于水.②Ca2+、A13+、Fe3+三种离子分别完全沉淀成为金属氢氧化物时溶液的pH为:Ca(OH)2:pH≥13; A1(OH)3:pH≥5.5; Fe(OH)3:pH≥4.1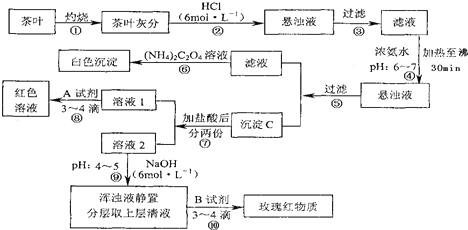
试根据上述过程及信息填空:
(1)步骤②加盐酸的作用是使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解).
(2)实验中检验Ca2+的离子方程式Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+.
(3)沉淀C中所含主要物质的化学式Fe(OH)3、Al(OH)3.
(4)步骤⑧用A试剂生成红色溶液的离子方程式Fe3++3SCN-?Fe(SCN)3.
(5)步骤⑨的作用是使Fe3+转化为Fe(OH)3沉淀;请你猜测步骤⑩的目的是检验Al3+(或铝元素)存在.
分析 茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物,以此进行解答.
解答 解:茶叶经灼烧,茶叶灰中含有钙、铁、铝三种金属元素,加入盐酸后可生成可溶性的氯化物,经过滤后,在滤液中加入氨水调节pH6~7,加热至沸30min,经过滤得到的沉淀C为氢氧化铝和氢氧化铁沉淀,滤液为氯化钙溶液,加入草酸铵后可得草酸钙沉淀,在滤液中加入盐酸后分为两份,加入试剂A,溶液变成红色,则A应为KSCN溶液,溶液2中加入6mol/L的NaOH溶液调pH至4,可得到氢氧化铁沉淀,浊液静置分层后上层清液为氯化铝溶液,加入试剂B可检验铝离子,生成红色络合物;
(1)向茶叶灰分中加盐酸的作用是将其中的Ca2+、Al3+、Fe3+溶解,
故答案为:使Ca2+、Al3+、Fe3+浸出(或使Ca2+、Al3+、Fe3+溶解);
(2)⑤过滤后所得滤液中含Ca2+,检验Ca2+的离子方程式为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+,
故答案为:Ca2++(NH4)2C2O4=CaC2O4↓+2NH4+;
(3)步骤④在pH为6-7时加热30 min,可使Al3+、Fe3+转化成Al(OH)3和Fe(OH)3沉淀,
故答案为:Fe(OH)3、Al(OH)3;
(4)步骤⑧是检验Fe3+,可加入KSCN 或NH4SCN进行检验,溶液变红色,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe3++3SCN-=Fe(SCN)3;
(5)步骤⑨将pH值调节至4~5,此时铝离子没有沉淀而铁离子沉淀完全,步骤⑩分离后用玫瑰红物质可检验Al元素的存在,
故答案为:使Fe3+转化为Fe(OH)3沉淀;检验Al3+(或铝元素)存在.
点评 本题考查了物质性质和组成的实验探究实验分析判断,侧重于学生的分析和实验能力的考查,为高考常见题型,流程中的试剂特征和反应现象是解题关键,题目难度中等.

| A. | KNO3 | B. | C | C. | KNO3、S | D. | N2、CO2 |
| A. | 质量数为13 | B. | 中子数为6 | C. | 质子数为6 | D. | 最外层电子数为6 |
| A. | 由“HF比HCl稳定性好”,可推知HF比HCl沸点高 | |
| B. | 由“同温度下等浓度的Na2CO3溶液比Na2SO4溶液的pH大”,可推知C比S的非金属性弱 | |
| C. | 由“相同条件下,HF比HCl溶液的酸性弱”,可推知氟的非金属性小于氯的非金属性 | |
| D. | 由“某过程发生化学键断裂”,可推知该过程发生了化学变化 |
| A. | 钢化玻璃 | B. | 玻璃纸 | C. | 有机玻璃 | D. | 水玻璃 |
| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:
