题目内容
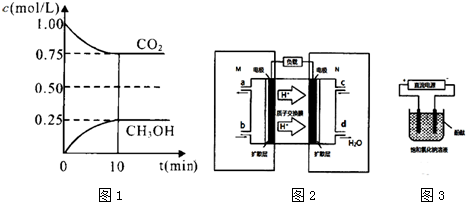
13. 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为:
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,产率高,易于实验室制备.其原理如图所示,其总电解反应为:Fe+2NaOH+2H2O$\frac{\underline{\;电解\;}}{\;}$Na2FeO4+3H2↑.
Ⅰ.实验过程中,X电极有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO${\;}_{4}^{2-}$)在溶液中呈紫红色.
(1)电解过程中,X极是阴极.
(2)生成高铁酸根(FeO${\;}_{4}^{2-}$)的电极反应是Fe+8OH--6e-=FeO42-+4H2O.
Ⅱ.若用不同种电池作为上述实验的电源,请分析电池反应.
(1)铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{充电}$2H2O+2PbSO4,则该铅蓄电池在充电时的阳极反应为
PbSO4-2e-+2H2O═PbO2+SO42-+4H+,若用此电池向外电路输出2mol电子,正极增重64g,电解质溶液消耗的硫酸根离子为1mol.
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应式为N2H4+4OH--4e-=N2+4H2O.
(3)以丙烷(C3H8)为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,导电电解质是熔融金属氧化物,写出该电池负极的电极反应C3H8-20e-+10O2-=3CO2+4H2O.
(4)当制备相同物质的量的高铁酸钾时,理论上上述三种电池中分别消耗的Pb、肼、丙烷的物质的量之比是10:10:5:1.
分析 Ⅰ.根据电源的正负极判断电解池中电极名称;
(2)该电解池中,阳极材料是活泼金属,则电解池工作时,阳极上铁失电子发生氧化反应,同时氢氧根离子失电子生成氧气,阴极上氢离子得电子发生还原反应;
Ⅱ.(1)充电时,阳极上硫酸铅失电子发生氧化反应,PbSO4(s)+2H2O-2e-=PbO2+4H++SO42-;正极发生反应:PbO2+SO42-+4H++2e-=PbSO4+2H2O,据此计算回答;
(2)从作为燃料电池时,负极发生氧化反应的角度可知N2H4被氧化生成N2;
(3)丙烷燃料电池的负极是燃料发生失电子的氧化反应,负极反应=电池反应-正极反应;
(4)制备相同物质的量的高铁酸钾时转移的电子数相等,据此计算回答.
解答 解:Ⅰ.(1)X电极连接原电池负极,所以是电解池阴极,故答案为:阴;
(2)铁是活泼金属,电解池工作时,阳极上铁失电子发生氧化反应,氢氧根离子失电子发生氧化反应,所以发生的电极反应式为:Fe-6e-+8OH-═FeO42-+4H2O和4OH--4e-═2H2O+O2↑,故答案为:Fe+8OH--6e-=FeO42-+4H2O;
Ⅱ.(1)充电时,阳极上硫酸铅失电子和水反应生成二氧化铅、硫酸根离子和氢离子,电极反应式为PbSO4-2e-+2H2O═PbO2+SO42-+4H+,若用此电池向外电路输出2mol电子,此时正极发生反应:PbO2+SO42-+4H++2e-=PbSO4+2H2O,此时正极从二氧化铅到硫酸铅,电极上相当于增加1molSO2成分,质量增加64g,消耗硫酸根离子1mol,故答案为:PbSO4-2e-+2H2O═PbO2+SO42-+4H+;64;1.
(2)作为燃料电池时,负极发生氧化反应,电解质溶液是20%-30%的KOH溶液,N2H4失去电子被氧化生成N2,故答案为:N2H4+4OH--4e-=N2+4H2O;
(3)以丙烷(C3H8)为燃料制作新型燃料电池,导电电解质是熔融金属氧化物,电池反应为:,C3H8+5O2=3CO2+4H2O,电池的正极通入O2,发生反应:O2+4e-=2O2-,负极通入丙烷,发生失电子的氧化反应,电池反应-正极反应=负极反应,C3H8-20e-+10O2-=3CO2+4H2O,故答案为:C3H8-20e-+10O2-=3CO2+4H2O.
(4)1molPb、Cd、肼、丙烷失去的电子分别为2mol、2mol、4mol、20mol,所以根据得失电子守恒可知,Pb、Cd、肼、丙烷的物质的量之比是10:10:5:1,
故答案为:10:10:5:1.
点评 本题考查了原电池和电解池原理以及燃料电池电极反应式的书写和电子守恒的计算知识,综合性强,难度较大.

| A. | 稀硫酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-1(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ•mol-1 | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,则可知C的标准燃烧热为110.5kJ•mol-1 | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量,则Fe(s)+S(g)═FeS(s)△H=-95.6kJ•mol-1 |
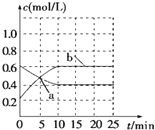 2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )
2NO2(g)?N2O4(g)△H<0.现将NO2和N2O4混合气体通入恒温密闭容器中,反应中物质浓度随时间的变化如图.下列说法正确的是( )| A. | a点表示反应处于平衡状态 | |
| B. | 25 min末,若增大压强,化学平衡常数增大 | |
| C. | 25 min末,若升高温度,NO2的体积分数减小 | |
| D. | 10min内用N2O4表示的平均速率为0.02mol•L-1•min-1 |
| A. | 容量瓶事先未烘干 | B. | 定容时观察液面仰视 | ||
| C. | 定容时观察液面俯视 | D. | 定容,摇匀后有少量液体流出 |
| A. | 定容时俯视观察液面 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 溶解所用的烧杯、玻璃棒未洗涤 | |
| D. | 转移溶液时不慎将少量液体洒落在外 |
| A. | $\frac{(n-2m)}{V}mol•{L^{-1}}$ | B. | $\frac{(n-m)}{V}mol•{L^{-1}}$ | C. | $\frac{(2n-2m)}{V}mol•{L^{-1}}$ | D. | $\frac{(2n-4m)}{V}mol•{L^{-1}}$ |