题目内容
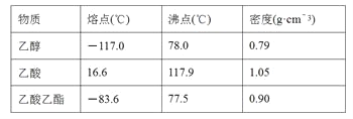
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图,下列说法不正确的是
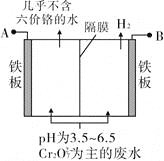
A. A接电源正极
B. 阳极区溶液中发生的氧化还原反应为Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O
C. 阴极区附近溶液pH降低
D. 若不考虑气体的溶解,当收集到H213.44 L(标准状况)时,有0.1 mol Cr2O72-被还原
【答案】C
【解析】试题分析:A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故A为电源正极,故A错误;B.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,发应的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故B正确;C.阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,故C错误;D.13.44 L氢气的物质的量为![]() =0.6mol,根据电子转移守恒n(Fe2+)=
=0.6mol,根据电子转移守恒n(Fe2+)=![]() =0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×
=0.6mol,根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×![]() =0.1mol,故D错误;故选B。
=0.1mol,故D错误;故选B。

 小题狂做系列答案
小题狂做系列答案【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D. =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
【题目】下列“实验结论”与“实验操作及现象”不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 把一小块钠放入水中,立刻熔成小球 | 该反应是放热反应 |
B | 向某溶液中加入AgNO3溶液,产生白色沉淀 | 该溶液中一定含有Cl- |
C | 向NaHCO3溶液中滴入酚酞溶液,溶液颜色变红 | NaHCO3溶液显碱性 |
D | 向某溶液中加入NaOH溶液,生成的白色絮状沉淀迅速变成灰绿色,最后变成红褐色 | 该溶液中一定含有Fe2+ |
A.AB.BC.CD.D