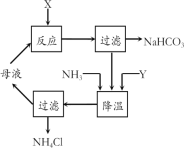
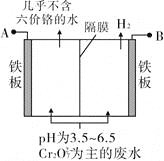
题目内容
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D. =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度
【答案】B
【解析】
A.根据图中数据判断,当pH=6.10时,c(HCO3-)=c(H2CO3),当pH>6.10时,c(HCO3-)>c(H2CO3),所以pH=7的血液中,c(HCO3-)>c(H2CO3),A正确;
B.温度不变,水的离子积常数不变,所以正常体温下c(H+)c(OH-)不变,B错误;
C.人体发生酸中毒时,可静脉滴注弱碱性物质解毒,碳酸氢钠溶液呈弱碱性,所以人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒,C正确;
D.由表中数据可知,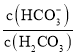 =20.0时,溶液呈碱性,说明碳酸的电离程度小于碳酸氢根离子水解程度,D正确;
=20.0时,溶液呈碱性,说明碳酸的电离程度小于碳酸氢根离子水解程度,D正确;
故合理选项是B。

【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验I:将Fe3+转化为Fe2+
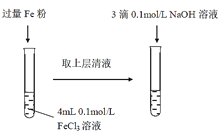
(1)常温下,FeCl3溶液显酸性,用离子方程式表示其显酸性的原因___。
(2)Fe3+与Fe粉发生反应的离子方程式为___。
(3)滴加NaOH溶液观察到的现象为___。
实验II:将Fe2+转化为Fe3+
实验方案 | 现象 |
向3mL0.1mol/LFeSO4溶液中加入1mL8mol/L稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:
查阅资料:Fe2++NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(4)用离子方程式解释NO产生的原因___。
(5)从化学反应限度的角度对体系中存在的反应进行反应I:Fe2+与HNO3反应;反应II:Fe2+与NO反应
①乙认为反应I是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是___。
②查阅资料反应I的速率比反应II慢,请用化学平衡移动原理解释溶液由棕色变为黄色的原因___。
(6)丙认为若生成的NO与Fe2+不接触,溶液就不会出现棕色,请画出实验装置图,实现Fe2+![]() Fe3+的转化,同时避免出现此异常现象。___
Fe3+的转化,同时避免出现此异常现象。___