题目内容
【题目】运用氧化还原反应的有关知识回答下列问题.
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质.则在Cu、Fe、Ag中,的还原性最强;在Cu2+、Fe2+、Ag+中,的氧化性最强.
(2)在下列反应中:
A.2F2+2H2O═4HF+O2 B.2Na+2H2O═2NaOH+H2↑
C.CaO+H2O═Ca(OH)2 D.2H2O ![]() 2H2↑+O2↑
2H2↑+O2↑
①水只作还原剂的是
②水既不作氧化剂又不作还原剂的是 .
(3)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O. 取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.
MnCl2+Cl2↑+2H2O. 取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4L.
请回答下列问题:
①写出该反应的离子方程式 .
②该反应中,氧化剂是 , 氧化产物是 .
③反应中被氧化的HCl的物质的量为 .
④实验室备用的浓盐酸质量分数为36.5%,密度为1.19gcm﹣3 , 为使用方便,请计算出该浓盐酸中HCl的物质的量浓度 .
【答案】
(1)Fe;Ag+
(2)A;C
(3)MnO2+2Cl﹣+4H+ ![]() Mn2++Cl2↑+2H2O;MnO2;Cl2;2mol;11.9mol/L
Mn2++Cl2↑+2H2O;MnO2;Cl2;2mol;11.9mol/L
【解析】解:(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质,则铁置换出Cu,Cu置换出Ag,所以还原剂Fe>Cu>Ag,故还原性最强的是Fe;Cu2+、Fe2+、Ag+中氧化性强弱为Ag+>Cu2+>Fe2+ , 氧化性最强的是Ag+;
所以答案是:Fe;Ag+; (2)A.2F2+2H2O═4HF+O2 , O元素的化合价升高,是还原剂;
B.2Na+2H2O═2NaOH+H2↑氢元素的化合价降低是氧化剂;
C.CaO+H2O═Ca(OH)2 无元素化合价的变化;
D.2H2O ![]() 2H2↑+O2↑,水既是氧化剂,也是还原剂;
2H2↑+O2↑,水既是氧化剂,也是还原剂;
所以答案是:①A; ②C;(3)①反应离子方程式为:MnO2+2Cl﹣+4H+ ![]() Mn2++Cl2↑+2H2O,所以答案是:MnO2+2Cl﹣+4H+
Mn2++Cl2↑+2H2O,所以答案是:MnO2+2Cl﹣+4H+ ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②二氧化锰是氧化剂,浓盐酸是还原剂,所以答案是:MnO2;Cl2;
③被氧化的HCl生成氯气,根据氯原子守恒,被氧化HCl的物质的量为1mol×2=2mol,所以答案是:2mol;
④根据c= ![]() 可知,浓盐酸质量分数为36.5%,密度为1.19gcm﹣3 , 则该浓盐酸的物质的量浓度为
可知,浓盐酸质量分数为36.5%,密度为1.19gcm﹣3 , 则该浓盐酸的物质的量浓度为 ![]() mol/L=11.9mol/L,所以答案是:11.9mol/L.
mol/L=11.9mol/L,所以答案是:11.9mol/L.

 考前必练系列答案
考前必练系列答案【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
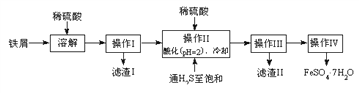
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)
【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A.0.2mol/(Ls)
B.0.4mol/(Ls)
C.0.6mol/(Ls)
D.0.8mol/(Ls)
【题目】节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
n/mol | 0.30 | 0.20 | 0 | 0 |
①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的化学反应速率v(CO2)=___________________;平衡时,容器中CO的转化率为_____________
②下图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是_______________(写出一条即可)。

(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
容器 编号 | c(CO)/ mol·L-1 | c(O2)/ mol·L-1 | c(CO2)/ mol·L-1 | v(正)和v(逆) 比较 |
Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
Ⅱ | 5.0×10-4 | 4.0×10-4 | 6.0×10-2 | v(正)______v(逆) |
该温度下,2CO(g)+O2(g)![]() 2CO2(g)的平衡常数为____________
2CO2(g)的平衡常数为____________


