题目内容
【题目】节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g),ΔH<0,800℃下,在2 L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
n/mol | 0.30 | 0.20 | 0 | 0 |
①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的化学反应速率v(CO2)=___________________;平衡时,容器中CO的转化率为_____________
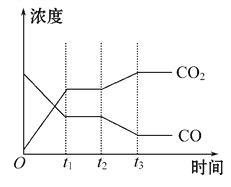
②下图表示上述反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是_______________(写出一条即可)。
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
CO2(g)降低其浓度。某温度下,在两个容器中进行上述反应,容器中各物质的浓度及正、逆反应速率关系如下表所示,并请在表中的空格处填写“>”“<”或“=”。
容器 编号 | c(CO)/ mol·L-1 | c(O2)/ mol·L-1 | c(CO2)/ mol·L-1 | v(正)和v(逆) 比较 |
Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
Ⅱ | 5.0×10-4 | 4.0×10-4 | 6.0×10-2 | v(正)______v(逆) |
该温度下,2CO(g)+O2(g)![]() 2CO2(g)的平衡常数为____________
2CO2(g)的平衡常数为____________
【答案】 0.012mol·L-1·min-1 60% 降低温度或减小氢气的浓度或增大水蒸气的浓度 > 1×108L·mol-1
【解析】(1)①容器体积为2L,可以求出反应物的浓度:
CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
初始:0.1 0.15 0 0
反应: X X X X
平衡:0.1-X 0.15-X X X
所以有![]() ,解得X=0.06。
,解得X=0.06。
所以![]() 。
。![]()
②t2时刻改变条件以后,二氧化碳的浓度增加,一氧化碳的浓度降低,所以可以是降低温度使平衡向正反应方向进行,或者也可以减小氢气的浓度,使二氧化碳的浓度增加,一氧化碳的浓度降低。最后,也可以加入水蒸气,平衡向正反应方向移动,使二氧化碳的浓度增加,一氧化碳的浓度降低。
(2)实验Ⅰ中正逆反应速率相等,反应达平衡,可以计算该反应的平衡常数为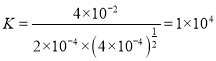 。实验Ⅱ的
。实验Ⅱ的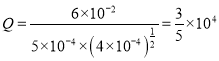 ,因为Q<K,所以反应向正反应方向进行,v(正)>v(逆)。
,因为Q<K,所以反应向正反应方向进行,v(正)>v(逆)。
该温度下,2CO(g)+O2(g)![]() 2CO2(g)的平衡常数为CO(g)+
2CO2(g)的平衡常数为CO(g)+ ![]() O2(g)
O2(g)![]() CO2(g)的平衡常数的平方,所以是1×108L·mol-1。
CO2(g)的平衡常数的平方,所以是1×108L·mol-1。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案